派思维新 | 优质系统性红斑狼疮动物模型解决方案,助力肾脏疾病药物研发

系统性红斑狼疮

系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种系统性自身免疫类疾病,以全身多系统脏器受累、反复的发作和缓解、存在大量自身抗体为主要临床特点[1]。SLE的临床表现具有高度异质性,系统受累表现多样,病程和疾病严重程度不一。该疾病的症状包括面部蝶形红斑、口腔溃疡、关节炎、肾脏受累和神经系统受累等。

自发性狼疮小鼠模型

近年来通过对 SLE 患者基因组进行的广泛筛查,发现多个基因位点可能是诱使 SLE 发生的风险因素,遗传因素可能是 SLE 发生的主导因素[2]。在动物水平上,一些自发性狼疮小鼠,例如 NZB × NZW F1小鼠和MRL/lpr 小鼠,能够模拟人类 SLE 的部分症状,帮助人们了解 SLE 发病的机制。
NZB×NZW F1小鼠
—————————————
NZB×NZW F1小鼠是NZB(New Zealand black mouse)与NZW(New Zealand white mouse)的杂交一代[3]。NZB × NZW F1 可产生类似于人的 SLE 症状[4-5],包括: 1月龄时即出现胸腺组织退化、胸腺上皮萎缩及免疫缺陷、淋巴结病和脾肿大;4 -5月龄时出现 ANA 和以 IgG2a、IgG3 为主的 anti-dsDNA IgG 等自身抗体水平的升高、尿蛋白水平显著升高并伴有全身水肿;5-6月龄时出现免疫复合物沉积引起的系膜增生性肾小球肾炎,并常伴有新月体形成;10-12月龄出现肾衰竭等。
MRL/lpr小鼠
—————————
MRL /lpr 小鼠由 Murphy 和 Roths 于 1978 年建立,由 LG/J、AKR/J、C3H /HeDi 和 C57BL /6J 品系小鼠复杂交配产生,第 12 代时发生常染色体隐性突变而区分成两个亚系,其中一个亚系为淋巴增殖基因( lymphoproliferation gene,lpr) 突变丢失的 MRL/MpJ-Fas lpr( 即 MRL /lpr) 品系,另一亚系为MRL /MpJ lpr/Fas即(MRL + / +)品系[6]。MRL /lpr 小鼠由于缺失 Fas 基因而容易引起淋巴结病,同时由于 Fas 所介导的凋亡受到干扰,活化的淋巴细胞和自体反应的 T 细胞和B 细胞的存活时间明显延长,最终使机体自身免疫过度上调,表现出部分狼疮样病理特征[7]。
MRL /lpr 小鼠在 3 月龄时可观察到明显的全身性淋巴结肿大,并随日龄增加而逐渐增大。血液中免疫球蛋白的含量明显升高,5 月龄时为正常小鼠的 5 倍,其中 IgG 约为正常小鼠的6-7倍。血液中补体滴度随月龄增加而下降,与人类 SLE 病理进程相似。抗 ssDNA 抗体、ds-DNA 抗体、Sm 抗体和ANA 等各种抗体也在2-3月龄时随日龄而上升。MRL /lpr 小鼠多于3-6个月出现蛋白尿和肾功能受损现象。MRL /lpr 小鼠也依据其性别的不同而表现出不同的死亡率,雌性鼠大约于 17 周龄死亡,而雄性鼠多于 22 周龄死亡[8]。
派思维新MRL/lpr小鼠模型案例分享
模型:自发型红斑狼疮模型
动物:雌性 MRL/MpJ-Faslpr小鼠、雌性MRL/MpJ 小鼠(11周龄)
组别: 空白组、模型组、阳性药组(泼尼松)
检测指标: 临床评分、脾胀指数、尿蛋白、抗双链DNA抗体、肾脏(HE)

图1.2.1 自发型红斑狼疮样动物模型(MRL/lpr小鼠)
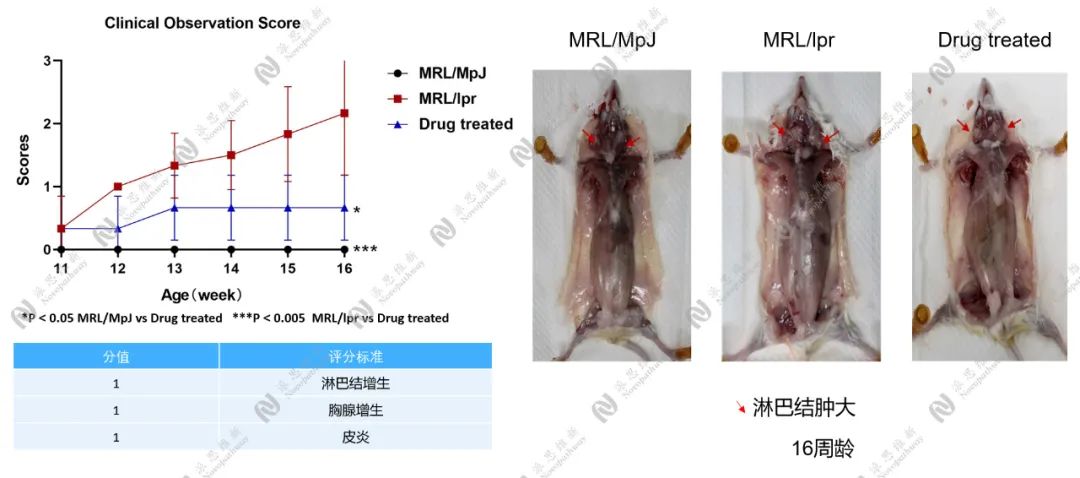
图1.2.2 自发型红斑狼疮样动物模型-临床评分

图1.2.3 自发型红斑狼疮样动物模型-脾脏指数


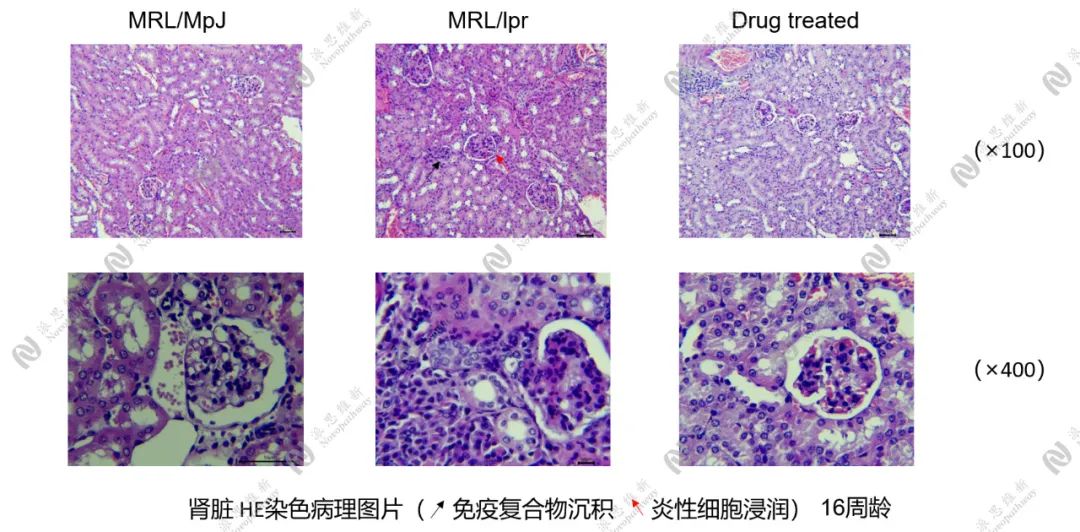
图1.2.6 自发性红斑狼疮样动物模型-肾脏(病理)


药物引诱造模

环境因素是诱使 SLE 病变不可或缺的因素[9]。近年来,人们建立了多种由外源物质诱发的狼疮鼠模型,为深入的阐明 SLE 的病理机制及寻找新颖的治疗策略提供了实验基础。
降植烷诱导小鼠模型
—————————————
降植烷是从矿物油中提取的一种有机烷类物质,可诱导小鼠产生狼疮样症状。建模方法是单次腹腔注射 0. 5 mL 降植烷,具有操作简单、成模率高的特点。其机制可能与免疫失调以及干扰素过度产生有关。降植烷诱导的狼疮小鼠模型被认为是唯一可以模拟 SLE 患者体内干扰素过表达的小鼠模型。诱导 1 个月后 40% 小鼠开始出现抗 dsDNA 抗体,60% 小鼠开始出现抗 histone 抗体;2 -3 个月后,50%~70%小鼠体内狼疮特异性自身抗体如抗 Sm抗体开始显著上升;;8月龄小鼠 ANA 均呈阳性,出现滑膜增生、骨膜炎和边际侵蚀等类风湿性关节炎症状,肾小球 IgG 复合物和补体 C3 复合物沉积、细胞增殖、蛋白尿等肾小球肾炎症状。


人源化小鼠

人源化小鼠是指将人的细胞、组织和器官移植给免疫缺陷小鼠,或是表达人类基因的小鼠,从而达到在小鼠中重建人类免疫系统的目的,能更好地模拟人体免疫特征。
PBMC人源化小鼠
———————————
PBMC人源化小鼠模型是通过收集处于疾病活动期的SLE患者外周血单个核细胞(Peripheral blood mononuclear cell, PBMC)移植到免疫缺陷小鼠体内制造的免疫系统人源化小鼠模型。该模型重建时间短(约1-2周),且重建以人源T细胞为主。同时,由于人源T细胞对小鼠受体的细胞的攻击,PBMC人源化小鼠会产生移植物抗宿主病(Graft vs. Host Disease, GvHD)导致PBMC人源化小鼠的实验窗口期较短(一般移植后第4-6周出现致死性GvHD)。
HSC人源化小鼠
——————————
HSC人源化小鼠是通过将人造血干细胞(hematopoietic stem cell, HSC)移植到免疫缺陷小鼠体内,人HSC在小鼠体内发育,产生多谱系人免疫细胞分化,包括淋系的T、B、NK细胞。由于这些人源免疫细胞是在小鼠体内发育而来,对小鼠产生免疫耐受,通常不会发生GvHD,小鼠寿命较长。NV-NSG-Plus3是第三代HSC人源化小鼠,可以在体内同时表达包括IL-3、GM-CSF,IL-15等多种细胞因子,大幅提高重建NK细胞、髓系细胞的比例,可以更快的构建SLE模型,模型建模的周期可以缩短到8周。
派思维新人源化小鼠模型案例分享-PBMC人源化小鼠
模型: 人源化SLE动物模型(PBMC)
动物: 雌性 B-NDG小鼠(6周龄)
组别: 空白组、模型组
检测指标: 尿蛋白、抗双链DNA抗体

图3.2.1 人源化SLE动物模型(PBMC)

图3.2.2 小鼠四周人源化T细胞重建结果
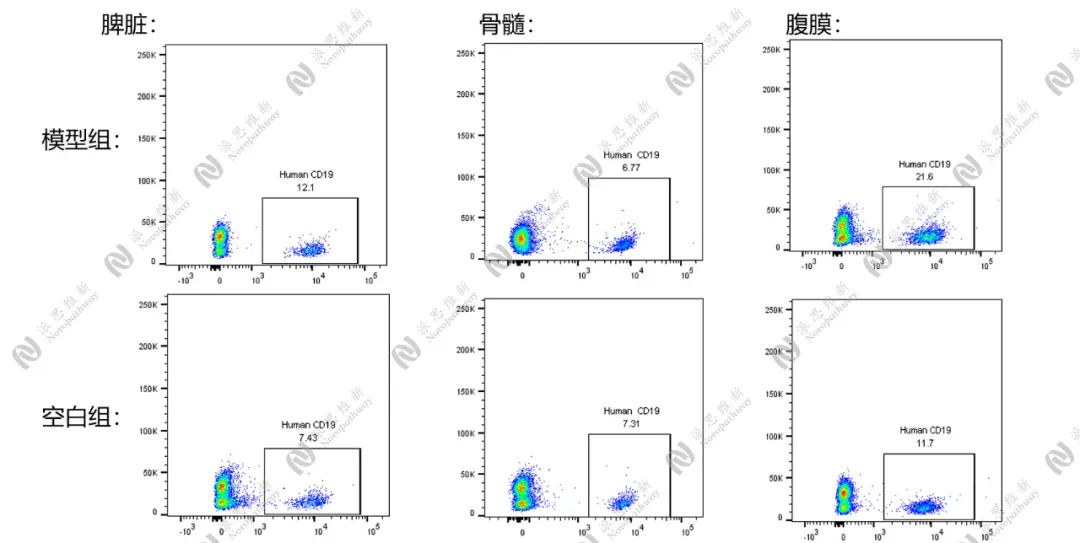
图3.2.3 小鼠四周人源化B细胞重建结果
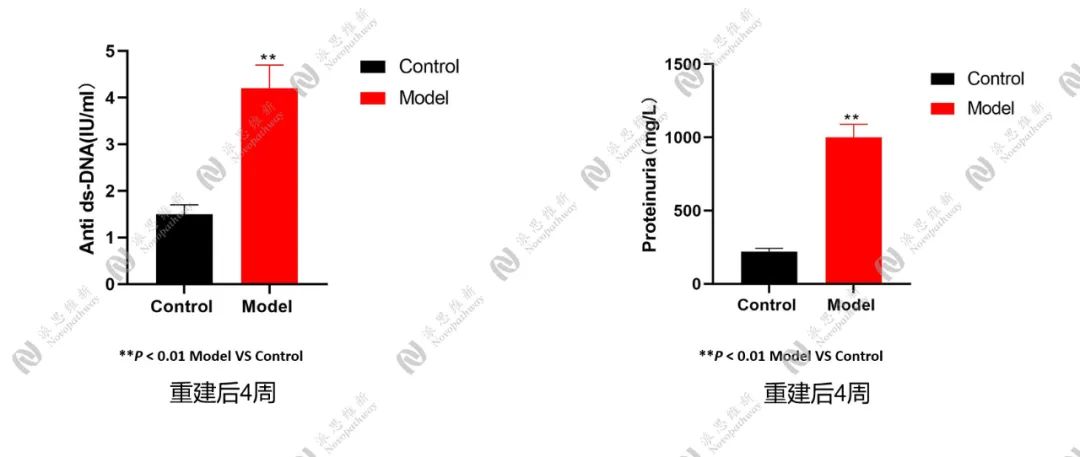
图3.2.4 人源化SLE动物模型(PBMC)标志物检测
派思维新人源化小鼠模型案例分享-HSC人源化小鼠
模型: 人源化SLE动物模型(NV-HSC-Plus3)
动物: 雄性 NV-HSC-Plus3 小鼠(8周龄)
组别: 空白组、模型组
检测指标: 尿蛋白、抗双链DNA抗体、肾脏(病理)

图3.2.5 人源化SLE动物模型(HSC)
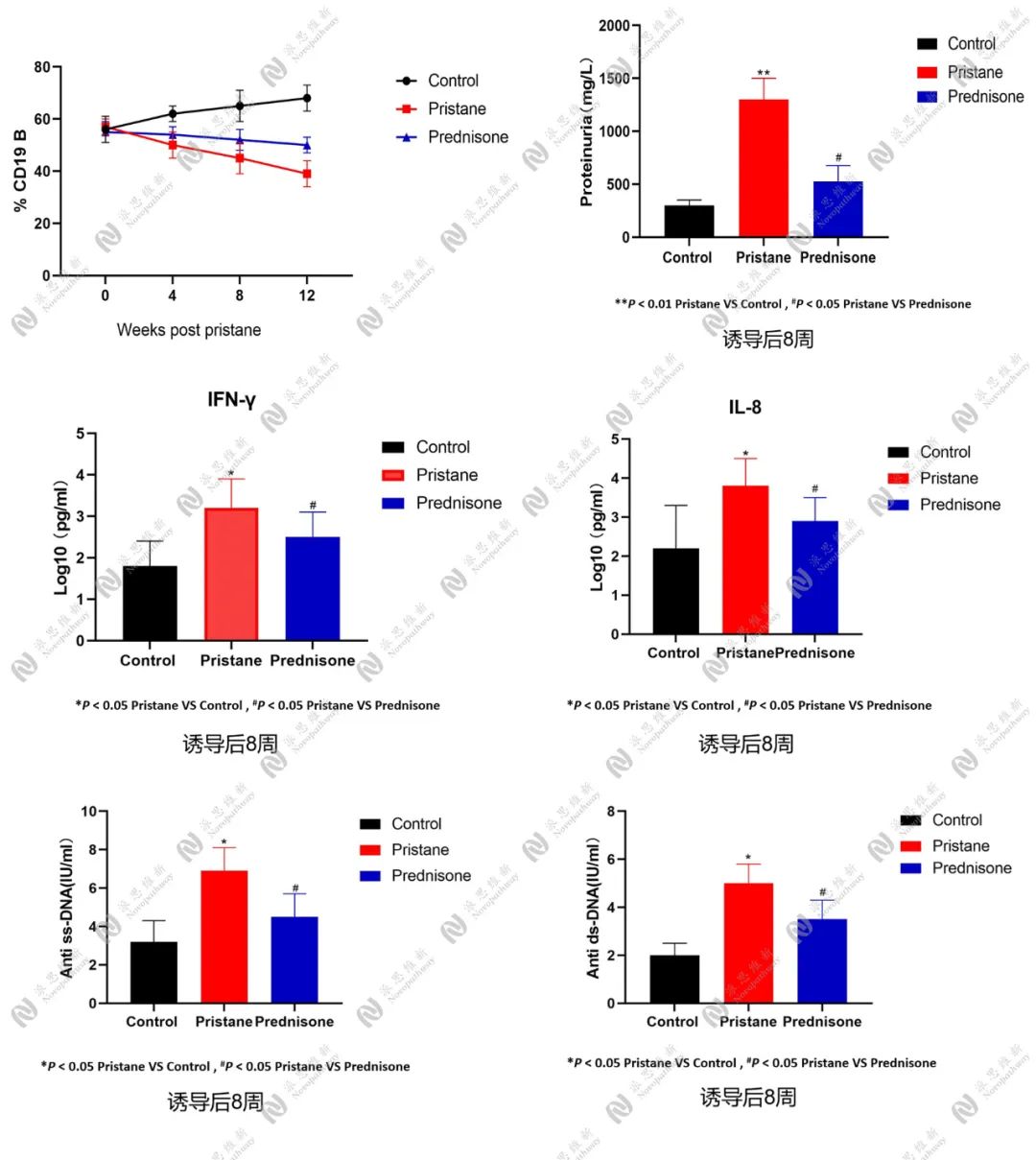
图3.2.6 人源化SLE动物模型(HSC)