生物分析专栏 | 轻度创伤性脑损伤生物标志物的研究进展及其生物分析
创伤性脑损伤(Traumatic Brain Injury, TBI)是由暴力作用于头部造成的结构性损伤或生理性破坏,可根据患者伤后的意识水平分为轻、中和重度。轻度TBI(Mild Traumatic Brain Injury, mTBI)占TBI的多数。mTBI临床表现为CT基本正常,创伤后遗忘低于24 h,意识丧失不到30 min或初始格拉斯哥昏迷评分(Glasgow coma scal,GCS)评分≥13,症状可伴随头痛、恶心、耳鸣、对光线过敏、意识模糊或其他认知障碍,如图1所示。

图1 mTBI的诊断原则[Zetterberg H, 2018]
临床上诊断颅脑损伤主要依赖GCS评分、颅脑CT、核磁共振成像(MRI)等。CT敏感性较低且有辐射,多次进行CT照射增加了对颅脑的辐射,辐射有可能造成继发性脑损伤。MRI精确性虽高但时效性较差,并且和CT一样也只限于瞬时检测,不能动态监测。目前,对mTBI的诊断缺少统一的定义,临床上常根据患者的主观感受和自我描述的症状进行诊断,常常被认为是非特异性的临床症状。mTBI因病情轻,易被漏诊,故对其关注较少且治疗不充分,15%的mTBI患者在伤后一年以上会出现症状,从而会增加患痴呆症的风险,还可能引起慢性脑病或创伤后应激障碍。此外,运动引起的mTBI即运动性脑损伤(Sports-related concussion, SRC)亦不容忽视,据统计,在美国由运动引起的mTBI人数每年约160-360万人。运动员经常受到不同强度的头部撞击,有时很难判断这些碰撞是否会导致脑损伤,以及程度如何。目前的神经影像技术往往无法探测到头部撞击造成的轻度脑损伤,另外,有的运动员可能没有注意到细微的症状,或者不愿报告症状以免被逐出比赛,从而延误疾病的诊治。可见,探索mTBI的诊断方法至关重要。
生物标志物是客观评价生理或者病理状态,判断疾病发生、发展和预后的指标物,可反映生物机体在环境相互作用中发生的可被测定的特征性改变[Strimbu K and Tavel J A, 2010]。mTBI发生发展过程中会产生大量生物标志物,这些标志物在损伤早期就可出现在血清和脑脊液中,其敏感性和特异性往往比影像学检查更具优势,深入研究这些标志物的变化和机制,可以弥补传统诊断方式存在的不足,为mTBI的诊断和治疗提供新的依据和线索。生物标志物可作为疾病早期诊断和预后判断的依据,还可以为药物研发提供指标依据。本文将从mTBI生物标志物的产生途径、种类及特点、及其分析技术等几个方面进行介绍。
02
血脑屏障、类淋巴系统及神经细胞
脑中产生的生物标志物通过血脑屏障(Blood-brain barrier, BBB)和类淋巴系统两个途径到达外周循环,脑内液体的转运依赖类淋巴系统。生理状态下,从脑中产生的神经元和神经胶质相关蛋白到达外周循环的水平极低,大多数检测不到。当发生TBI导致神经血管,尤其是毛细血管受损时,中枢神经系统(central nervous system, CNS)相关蛋白会通过受损部位穿过BBB,然后,可通过类淋巴系统清除CNS相关蛋白。
2.1 血脑屏障(Blood-brain barrier, BBB)
BBB由紧密连接组织(tight junctions, TJs)将脑内皮细胞连接组成,包含大量细胞,包括脑微血管内皮细胞、星形胶质细胞、外膜细胞,它们共同维持CNS中神经细胞发挥功能。TJs由闭合蛋白和连接粘附分子连接而成,星形细胞脚紧紧贴在脑内皮细胞上。脑损伤不仅仅是指神经元的损伤,还包括星状胶质细胞、小胶质细胞、寡树突胶质细胞以及脑内皮的损伤。原发性损伤或继发性损伤可导致神经血管损伤。
原发性损伤可能会导致BBB内皮机械性变形,破坏TJs复合物的稳定性,破坏屏障的完整性。健康人TJs复合物可作为物理屏障与脑微血管内皮细胞连接形成腔室,与脑中血流分隔。
原发性损伤发生时,伴随BBB受损,会导致神经元和神经胶质相关蛋白的释放,增强脑微血管内皮细胞胞内和细胞旁的膜通透性,从而使得相关生物标志物进入体循环。
继发性损伤如脑代谢的改变、脑血流的波动、脑水肿、颅内压升高、免疫激活等都会增加BBB的通透性。
BBB通透性的改变会使从脑中进入外周循环中的生物标志物的量发生改变,如:神经元特异性烯醇化酶(the neuron-specific enolase,NSE)、泛素羧基末端水解酶L1(ubiquitin C-terminal hydrolase isozyme L1,UCH-L1)、轴索损伤生物标志物如神经纤维丝蛋白轻链(neurofilament light chain,NF-L)和tau蛋白,星形胶质细胞损伤生物标志物如S100β(proteins S100β)和GFAP。如图2所示。

图2 BBB结构示意图[Keisuke K, 2016] A:正常BBB;B:损伤的BBB
2.2 类淋巴系统(Glymphatic System)
2012年美国罗切斯特大学医学中心Jeffrey J.Iliff教授和Maiken Nedergaard教授及其团队采用双光子技术,首次发现了脑脊液与脑组织液进行交换的方式并将其命名为Glymphatic pathway,即为脑胶质-淋巴途径。由于其发挥着类似于外周淋巴系统的功能,又称为"类淋巴途径"。该途径主要包括:动脉周围脑脊液(cerebrospinal fluid, CSF)流入通道、静脉周围组织液流出通道以及连接两个通道的星形胶质细胞上的水通道蛋白-4(AQP-4)。CSF通过动脉周围间隙伴随动脉深入到脑实质内,并通过AQP-4与脑组织液进行交换,同时这种交换将会驱动代谢产物和组织液进入到静脉周围间隙,最终进入到CSF循环或通过毛细淋巴管进入到颈部淋巴管[MIR医学仪器与试剂, 2018]。
CSF是包围大脑的透明液体,可对大脑提供机械性保护,可以与脑间质液(interstitial fluid, ISF)自由交换,它可以向神经元运输营养成分和信号分子以及排出废物。脑中的生物化学变化会在CSF成分变化上得以体现。
中枢神经系统功能复杂,组织液中的代谢产物和异物的清除主要依赖于类淋巴系统。类淋巴系统解释了蛛网膜下的CSF进出脑的途径,同时,有助于我们理解含有脑损伤相关生物标志物的ISF进入外周循环的途径。CSF不与脑实质直接接触,可以通过小动脉内皮细胞和基底层狭窄的缝隙进入脑细胞的间隙,进入至细胞间隙中的CSF可以和ISF混合。CSF和ISF通过对流交换将废物从动脉运输至静脉,ISF可重新吸收进入蛛网膜下,也会通过静脉旁的区域运出脑,部分ISF会到达颈部的淋巴管排入锁骨下静脉进而至外周血循环中,如图3所示。CSF总体积大概有150 mL,脉络膜、第三、第四脑室产生的CSF会持续更新,产生和清除的循环速率约为20 mL/h [Zetterberg H, Blennow K, 2016]。
当神经血管受损时,细胞质和膜结合蛋白会被释放至CSF和ISF中,然后可通过星形细胞-水系统和脑动脉压进入血管旁区域(para-venous space)。脑中的生物化学变化会反应在CSF上,因为神经元存在于ISF中,CSF可以自由与ISF交换,所以,CSF中的生物标志物可以表征CNS系统的损伤。此外,CSF有较低的酶解率,样品中的大部分分子不会发生变化(要保证样品不会被血浆样品所污染)。

图3 类淋巴系统和CSF/ISF交换示意图[Keisuke K, 2016]
2.3 神经细胞和星形胶质细胞
神经元是具有长突起的细胞,由细胞胞体和突触组成,是神经系统结构、功能的基本单位,与神经胶质细胞共同组成神经组织。神经元存在于中枢和外周神经系统内,可处理并传输电和化学信号,可通过突触与相邻的神经元接口形成神经网络。突触又包括轴突和树突。树突是由细胞体向外伸出的许多树枝状较短的突起。轴突是由细胞体向外伸出的最长的一条神经纤维,可将电脉冲从神经元的胞体传导出去。星形胶质细胞广泛分布于哺乳动物脑内,为神经元提供支持和保护作用,还为形成血脑屏障的内皮细胞提供生物化学支持,支撑神经元的生化和营养调节,并在受损中枢神经系统的修复和瘢痕形成过程中发挥作用,如图4所示。

图4 mTBI相关的可能标志物[Zetterberg H, 2016]
03
mTBI潜在生物标志物
理想的TBI生物标志物应该具备以下几点特征:
①对脑组织具有高度特异性;
②敏感性高,且仅在脑组织受损后释放,不受非头部创伤的影响;
③受伤后立即释放到血液和脑脊液,且能反映损伤的时程;
④标志物水平与损伤的严重程度和临床预后密切相关[吴文天等,2018]。
TBI与其它疾病不同,如心肌缺血或者肝肾功能衰竭等可通过检测血中标志物可迅速进行诊断和治疗。目前,针对mTBI并无特异的生物标志物,仅有胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和泛素羧基末端水解酶L1(ubiquitin C-terminal hydrolase isozyme L1,UCH-L1)还处于验证阶段,FDA支持两者用于mTBI的大规模临床验证试验,以证明其作为mTBI生物标志物的可靠性。它们在mTBI患者伤后不久在外周血中升高,与患者的远期预后有关,且其水平不受非头部损伤的影响,是急诊科可用于诊断mTBI的最有效的神经生物标志物。
不同部位产生的生物标志物的变化水平可以指征损伤部位,如GFAP、S100β为星形胶质细胞损伤生物标志物等,tau蛋白、NF为轴索损伤生物标志物,UCH-L1、神经元特异性烯醇化酶(neurone specific enolase,NSE)为神经元损伤生物标志物。此外,比如内皮TJs蛋白如claudin或occludin可指征BBB的损伤。
TBI急性期和长期变化都需关注生物标志物。比如急性期在血中检测到TJs相关蛋白,以及过磷酸化Tau表示有重复性脑部累加性损伤。研究表明,大部分急性TBI的生物标志物水平在发生TBI几天后会恢复到基线,尤其是mTBI。mTBI的生物标志物一般会在亚急性期或慢性期就恢复到基线水平,所以寻找可以指征mTBI亚急性或慢性期的生物标志物较为重要。可见,检测TBI不同期(急性期、亚急性期、慢性期)生物标志物变化有利于检测疾病的发展进程从而实施有效干预措施,如图5所示。
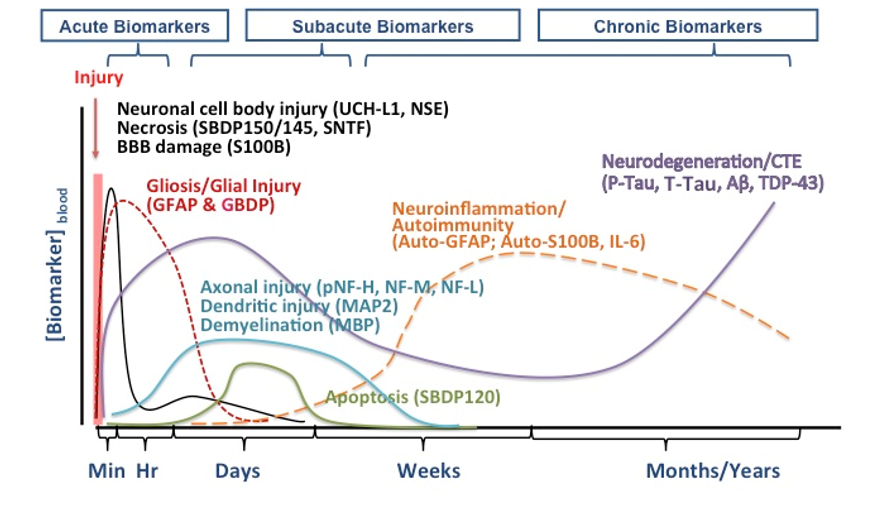
图5 生物标志物在不同时期TBI中的变化[Wang K K, 2018]
目前,脑损伤相关标志物绝大多数来自CSF和血浆/血清。
CSF标本的优点在于:
①受损脑组织分泌或释放的相关蛋白可直接进人CSF;
②CSF总量少,且相应的蛋白酶较少,故而CSF中的蛋白相对容易被检出;
③由于血脑屏障的缘故,CSF标本受外界其他因素干扰较小。
缺点是腰穿操作相对复杂且存在头痛等并发症。
血浆/血清样本的优点在于采样方便,更适合作为常规检查手段。
TBI生物标志物的研究较多是以血浆/血清样本为主。可以定性定量评估TBI的损伤程度、预测病人转归,判断慢性脑病(chronic traumatic encephalopathy, CTE)的进程及干预,或作为药物研发的手段等[吴文天等,2018]。
不同的创伤性脑损伤生物学标志物产生的机制、部位、生理作用以及在血清或脑脊液中的含量不同(如表1所示),下文对几种潜在的mTBI生物标志物的特点及其在病情评估及预后判断等方面进行逐一介绍。
表1 mTBI潜在的生物标志物及其特点
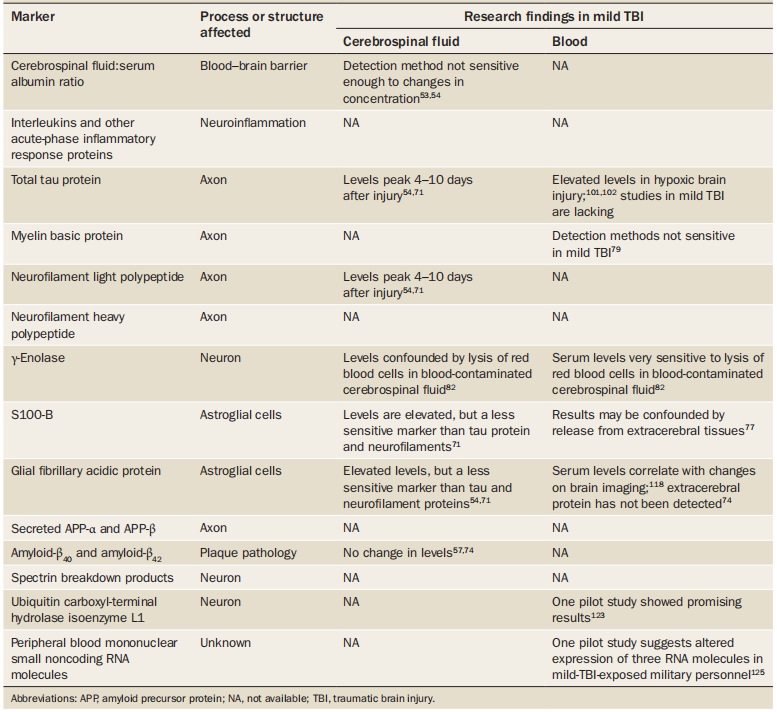
来源:[Zetterberg H, 2013]
3.1 星形胶质细胞损伤生物标志物
生物标志物S100β 和GFAP可用于反映星形胶质细胞损伤程度[李民涛等,2019]。
S100β
S100β主要存在于中枢神经系统的星形胶质细胞,是神经胶质细胞的标志蛋白。在大多数颅脑损伤中,神经胶质细胞和神经元都会有不同程度的损伤,星形胶质细胞表达S100β增强,释放入CSF和血中,如图6所示。颅脑损伤后,血清S100β蛋白水平与近期、中期或长期预后不良显著相关,检测血清S100β蛋白可作为判断颅脑损伤严重程度及判断中、重度脑损伤患者长期预后的重要指标[谢凤欣等,2020]。

图6 TBI介导的星形胶质细胞活化引起S100β的产生和释放[Keisuke K, 2016]
由于S100β也会表达于非神经组织(如脊髓损伤、四肢损伤中也能检测到),所以用于指示脑损伤特异性较低;而且,易受到患者年龄,采样时间等影响。血清S100β的敏感性和特异性较差,故不能代替CT等临床检查作为识别mTBI患者的工具,但血清S100β可用于辅助诊断以尽量减少辐射暴露。因此,S100β蛋白可适当用于急诊科早期对mTBI的筛查而不是诊断,且能否预测长期预后等尚需进一步证实。
GFAP
GFAP是一种表达于星形胶质细胞的中间丝蛋白,目前仅在中枢神经系统中发现,在检测TBI上具有较高特异性,正如前文提到,它是比较有研究前景的颅脑损伤标志物。TBI后脑脊液和血清中可检测到GFAP升高,其浓度可预测继发性脑损伤的情况,血清GFAP浓度的变化也可以反映脑损伤后胶质细胞和神经元的损伤程度,如图7所示。多项研究提示,CT显示的颅内有异常的患者血中GFAP水平比正常的患者的高,GFAP能够预测病情,准确地区分mTBI患者和无颅脑损伤的创伤患者。另外,GFAP也可用于预测患者是否需要手术干预,可减少其它不必要的检查[谢凤欣等,2020]。
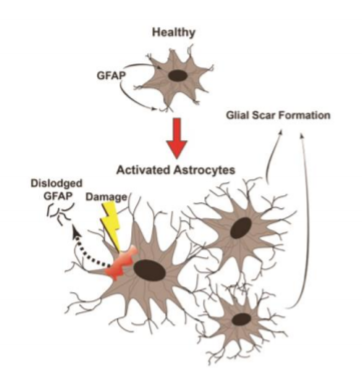
图7 反应性星形细胞胶质化[Keisuke K, 2016]
3.2 轴索损伤生物标志物
目前有三种生物标志物可用于反映轴突损伤,即 Alpha-Ⅱ血影蛋白降解产物(alpha-Ⅱspectrin breakdown products,SBDPs)、tau蛋白和神经纤维丝蛋白(neurofilament,NF)。
Tau蛋白
Tau蛋白(50-65 kDa)是神经细胞微管相关蛋白中的一员,在中枢神经系统中主要分布于神经元细胞的胞核、寡树突胶质细胞、星形胶质细胞中,在轴突稳定、神经元发育、神经元极性等方面起着重要作用,在外周系统的肝、肾、睾丸中均有表达。磷酸化tau是生理现象,但是过磷酸化且聚集神经纤维缠结是阿尔茨海默病和CTE的特征。Tau蛋白释放至脑脊液和血液中时表示轴突损伤。TBI发生时,tau蛋白将发生磷酸化成为P-tau,如图8所示。脑CSF中T-tau与严重TBI的损伤面积和结果相关,含量越高,表明损伤程度越重。而CSF中P-tau在TBI发生时以及其它急性脑损伤时浓度水平不发生改变[Hesse C, et al., 2001]。此外,P-tau磷酸化tau蛋白(P-tau)及其与总tau蛋白比(P-tau/T-tau)可有效评估TBI病人预后和死亡率[夏承东等,2020]。
研究发现血清tau蛋白水平可作为预测重型TBI预后的指标,其预测不良预后的敏感度为88%,特异度为94%。有研究显示,早期检测TBI患者的血清tau蛋白浓度不仅可以评估患者的受伤程度,而且能够有效地反映患者记忆受损的程度[谢凤欣等,2020]。但还有研究表明[Henrik Z.and Kaj B., 2018],血浆中的T-tau浓度与CSF浓度相关性差。但是,在急性缺氧性脑损伤中观察到tau双相性释放入血,第一个峰出现在伤后几小时,第二个峰在几天后出现。

图8 Tau磷酸化过程[Keisuke K, 2016]
还有研究表明[Gill J, et al, 2017],在SRC后6小时内血浆中Tau增加与重回赛场(Return to play, RTP)时间的延长相关。Tau蛋白在TBI后脑脊液中表达更高而在外周血中表达较低,且外周血中tau蛋白水平在诊断mTBI方面不准确,但可能与TBI患者的长期预后有关。Tau蛋白在中重度TBI患者脑脊液中表达较高,且可预测损伤的严重程度和预后。
NF-L
神经纤维丝蛋白(Neurofilament,NF)由神经元胞体合成,是神经细胞骨架的主要组成成分,特异性地分布于神经细胞胞体和突起内,由轻链(NF-L)、中链(NF-M)及重链(NF-H)个亚单位组成,在维持神经细胞正常形态、轴浆运输等方面发挥着重要作用。神经退行性病变、炎症及外伤等疾病导致轴突损伤时,脑脊液和血液中NF均可异常升高,NF对神经元细胞损害甚至神经元死亡均具有高度特异性的特点,使其相对于其他生物标志物具有重要的优势[索桂海和汤继宏, 2019]。
NF-L分子量约68 kD,结构如图9所示,在正常情况下,低水平的NF-L从轴索持续释放,且与年龄相关,年纪越大释放NF-L水平越高[Grant L I, et al, 2019]。TBI发生后,钙向细胞内流入可触发磷酸化级联反应导致轴突损伤。轴索损伤后,NF-L最早发生降解,因而NF-L是轴索损伤最为敏感及特异性的标记物之一。中/重型颅脑损伤患者的血浆NF-L水平显著升高。血清NF-L水平与CSF中呈相关性。

图9 神经纤维丝蛋白和NF-L结构示意图[Lorenzo G. et al, 2019]
NF-L为敏感但非特异的标志物(骨科损伤患者的血清NF水平,也存在表达增高现象),在受伤开始到血液中NF水平升高之间时间滞后,可能会限制NF在急性期作为辅助诊断的有效性。然而,可作为预测TBI患者预后的生物标志物。同时,和其它标志物仅在损伤后几小时内升高不同,NF-L可以在前两周持续升高,一年后有所下降,但仍未降至对照组水平。针对其特点可以将其作为神经保护药效学生物标志物。在TBI的常规检查中,血浆NF-L不可作为独立的生物标志物。反复mTBI,血中NF-L水平会升高,从临床的角度,血清NF-L有助于辨别持久性的脑震荡后综合征(post concussion symptoms,PCS),当RTP时作为参考性标志物可提供科学依据[Zetterberg H, et al, 2018; Bernick C, et al, 2018; Ljungqvist J C, et al, 2016]。此外,有研究表明,mTBI发生时,CSF中的T-tau和NF-L都会升高,但是NF-L的增加程度大于T-tau[Zetterberg H., et al., 2006]。
3.3 神经元损伤生物标志物
目前,有两种生物标志物可用于评估神经元损伤,即神经元特异性烯醇化酶(neurone specific enolase,NSE)和泛素羧基末端水解酶L1(ubiquitin C-terminal hydrolase isozyme L1,UCH-L1)。
NSE
NSE是存在于神经元胞体中的一种特异性糖酵解酶,在神经元损伤时可释放到细胞外。在急性情况下,血清NSE是神经元损伤程度的良好预测因子[Böhmer, et al., 2016],但因其还存在于神经内分泌细胞、寡树突胶质细胞、血小板以及红细胞中而缺乏神经元特异性,并可致溶血反应,故血液中的NSE难以检测或存在假阳性结果[Ramont, L., et al., 2005]。血清中NSE浓度水平与中、重度TBI呈正相关[Mercier E., et al., 2016]。大量研究结果表明,NSE可能为mTBI的潜在血清生物标志物,mTBI患者会在损伤后几小时出现血清中NSE的增加[Kruijk, et al., 2001; Wolf H, et al., 2013]。
UCH-L1
UCH-L1是一种半胱氨酸蛋白酶,主要表达于神经元上(如图10所示),也少量表达于神经内分泌细胞,这种酶占脑中总可溶性蛋白的2%,大脑中极为丰富。在正常或病理条件下可参与清除神经元中错误折叠氧化或过量的蛋白质。脑损伤后急性期血清UCH-L1水平升高与损伤严重程度相关,血浆UCH-L1水平在脑外伤后迅速升高,8 h左右达到高峰,并在48 h内快速下降。并且可提示患者损伤后6个月的死亡风险增加。同时,血清UCH-L1在预测mTBI的CT表现方面也具有高准确性,也具有成为mTBI的生物标志物的前景。

图10 细胞、轴索、突触中的UCHL1[Steven H G, 2016]
UCH-L1和GFAP在患者颅脑受伤后的外周血中水平升高且与患者的远期预后有关。同时检测分析UCH-L1和GFAP的结果优于单独分析一种,单独分析这两种生物标志物对于区分TBI患者和健康对照者均具有良好的敏感性(对于UCH-L1和GFAP,受试者特征分析曲线下面积分别为0.87和0.91),而将两者结合起来分析诊断mTBI有更高的灵敏度和特异度[Michael M., et al, 2020]。此外,有研究采用3462例受试者进行试验发现[Papa L., et al, 2019]:无论是成年人还是孩子TBI,GFAP优于UCH-L1;血中GFAP和UCH-L1的水平在非脑震荡损伤患者和脑震荡损伤患者中都逐渐升高,UCH-L1在非脑震荡损伤患者中的变化水平高于GFAP,孩子更为明显。还有研究表明,GFAP,UCH-L1和S100β用于快速预测在0-8小时内CT阳性的TBI具有优势。其中,以GFAP的结果最为明显,提示其在预测脑损伤CT阳性结果上的应用前景。
临床上还没有应用于mTBI的生物标志物,相关研究面临诸多挑战,如:ISF进入至外周循环系统,其中的机制还不清楚;CSF或者血中的生物标志物水平变化内在涵义及其解读具有较大的挑战等都有待于进一步研究。
04
生物分析
CNS中的生物标志物需透过BBB才可能在外周中被检测到,如果其在CSF中的水平较低,则在血中的浓度水平会更低,如血浆中的Aβ42和tau较脑脊液中两者的水平分别低约30倍和100倍[Janelidze S, 2016; Blennow K, 2017 ]。通常,CNS相关的生物标志物在血浆或血清中的浓度极低。如果生物标志物不仅表达于CNS还表达于外周组织,若外周组织发生创伤,则会产生高背景值的干扰,CNS损伤对标志物水平变化的贡献将可能被掩盖;另外,血中其它大量的蛋白(如白蛋白、免疫球蛋白等,成年人含50-70 g/L)和异嗜性抗体(heterophilic antibodies)等对检测会产生干扰[Li D, 2019];血中的生物标志物还可能会被酶解等都会影响结果的判断[Zetterberg H and Blennow K, 2016]。可见,mTBI生物标志物的生物分析面临巨大挑战。
mTBI生物标志物的生物分析常采用免疫化学法,其中以酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)最为常见[Henrik Z.and Kaj B, 2018; Zetterberg H and Blennow K, 2016]。但ELISA法存在灵敏度低和特异性差等问题。随着检测技术的发展,超高灵敏度检测设备可以克服背景干扰,实现低浓度水平生物标志物的准确定量,如二代免疫分析技术,电化学发光分析技术、质谱分析技术、单分子检测技术等。
以EUROIMMUN和Elecsys为代表的二代免疫分析在临床试验研究中表现出较好的分析优势[Lifke V. et al., 2019; Chiasserini D., et al., 2016]。电化学发光平台如Meso Scale Discovery(MSD)与传统的免疫分析实验相比具有灵敏度高、低背景干扰、具有较宽的动态范围、多指标同时检测等优势,在T-tau和NF-L的检测中均有应用。另外,具有较高的灵敏度和多指标检测能力的液相色谱-质谱联用技术也有应用在p-Tau217检测的报道[Barthélemy N.R, et al, 2016 和2020],局限是需要的大体积血提取tau,并且方法不适用于快速操作。
数字式单分子免疫阵列分析平台(Simoa)比现有的常规免疫检测方法灵敏度更高,整体水平能够到飞克每毫升级别(fg/mL),是对免疫检测方法定量下限的突破。为生物样本中极低浓度的蛋白定量和检测提供了一种新颖的超灵敏方法。与传统免疫分析平台相比,新技术具有明显的技术优势:基于磁珠(bead)方法的引入,加上单分子检测的标准化和放大检测信号的能力,实现超高灵敏度和更大的动态范围。通过在Simoa微孔阵列光盘的二十多万个飞升大小的孔中,捕获和密封磁珠上的单个免疫复合物,采用数字算法,可直接对体液中微量蛋白进行超高灵敏度定量分析。除了在灵敏度上的改进外,Simoa平台还是一个完全自动化的系统。仪器为全自动化平台,可以进行样品稀释(高达1:10稀释)、混合、洗涤、培养和数据采集步骤。
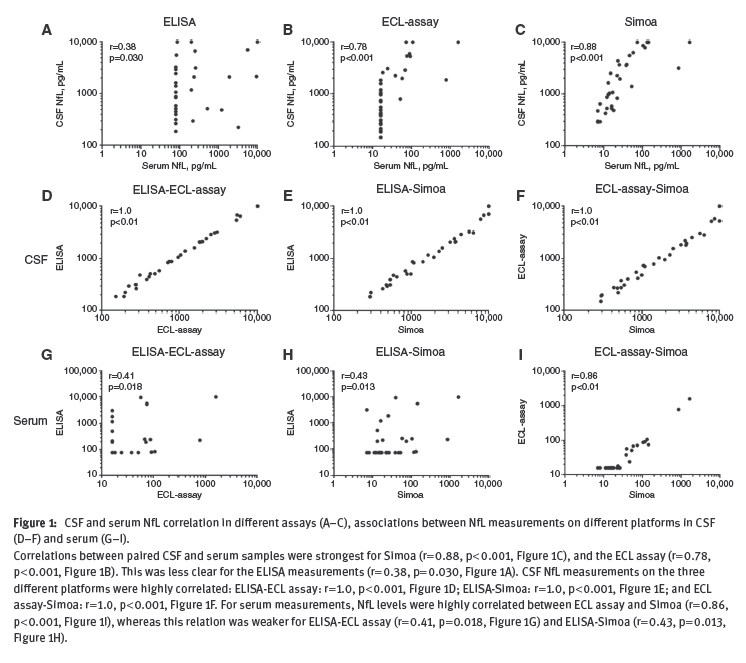
图11 CSF和血清中NF-L在不同的实验平台中的相关性[Jens K, et al., 2016]
Simoa可实现低水平蛋白定量,如NF-L [Jens K, et al., 2016; Hendricks R, et al., 2019],检测灵敏度是ELISA的126倍,是ECL的25倍(如图11所示)。ECL和Simoa的相关性好,但ECL无法定量低于15.6 pg/mL (20 of 33 samples)的样品。
Simoa的4重指标商品化试剂盒可以实现同时对患者血中mTBI潜在生物标志物GFAP、UCH-L1、NF-L、Tau的定量分析(如图12所示)。

图12 Simoa在检测运动脑损伤患者血中GFAP、UCH-L1、NF-L、Tau的应用[Michael McCrea, et al., 2020]

阳光德美的Simoa HD-X
05
结语
mTBI潜在生物标志物对疾病的诊断和判断预后具有重要作用,可以从不同角度来反映mTBI各个时期的生理病理变化,但真正进入临床应用还需要多中心、大样本的研究来证实这些标志物的应用价值。目前,还没有应用于mTBI的诊断和判断预后的高特异性和高敏感性的单一生物标志物。联合多种标志物或标志物与影像学联合检查来提高诊断的准确性可能在mTBI的诊治中发挥重要的作用。尤其,随着现代检测技术水平的提高,也势必会推动mTBI生物标志物的研发和应用。
- 上下滑动查看参考文献 -
文章来源:阳光德美微信公众平台



