生物分析专栏|前体药物的生物分析
前体药物(prodrug),也称前药、药物前体、前驱药物等,是指一类体外活性较小或无活性,在体内经酶或非酶作用,释出活性物质而发挥药理作用的化合物。而此类有活性的化合物称之为母体药物或者原药。
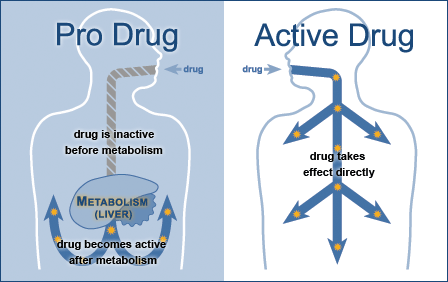
图1:前体药物和原药的体内过程[1]
许多药物在临床应用上均存在一些问题,如口服吸收不完全,生物利用度低,因而影响血药浓度和体内暴露量;或是体内分布不理想,产生非期望的毒副作用;还有一些药物水溶性小,不便制成注射剂,或在注射部位析出导致疼痛;又或是因首过效应被代谢破坏,发生降解,使半衰期缩短等等。这些问题的出现均与药物的化学结构有关,而前体药物的设计则解决了这些问题。药物的化学结构是决定药物理化性质和与受体结合、发挥疗效的关键。因此对药物的化学结构进行适当修饰,将其制成前体药物,则可以改变药物的理化性质,以改善药物的稳定性和其在体内的吸收、分布、转运、代谢和排泄等药代动力学过程。前体药物的设计有很多优势,如提高了药物的生物利用度和药物对靶部位作用的选择性,增加了药物稳定性,去除或降低了毒副作用,改善了药物的不良气味,减少局部给药后的刺激或疼痛,促使药物长效等[2,3],可在不同程度地克服上述所提及的问题。
理想的前体药物是前体药物克服影响药物起作用的屏障后及时地释放出活性代谢产物,见图1。前体药物的整体性质应是无活性、无毒、易于合成的,在作用部位之外化学稳定且是生物可逆的,原药在体内容易再生,从而发挥药理活性。
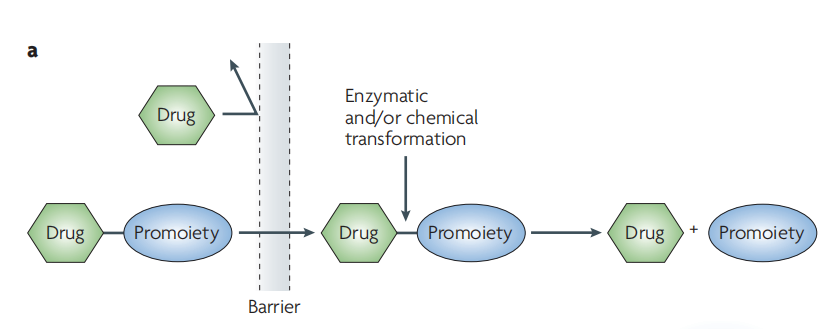
图1:前体药物设计的概念图[4]
注:Promoiety:一种用于修饰药物的官能团,以改善物理化学、生物制药或药代动力学特性。
前药的特征一般包括:
(1)前药应无活性或活性低于原药;
(2)原药与载体一般以共价键连接,在体内转化成原药,此过程可以是酸、碱水解过程或酶促转化过程;
(3)前药在体内转化成原药的速率应较快,以保障原药在靶位有足够的药物浓度;但当修饰原药的目的是为了延长作用时间时,则可设计代谢速度缓慢的前药[5];
(4)前药与载体分子应无毒,且载体分子应迅速的从体内清除。
前体药物设计时,最常见的形式是对含羧基、羟基、氨基的药物进行结构修饰,制成酯、羧酸酯、氨基酸酯、酰胺、磷酸酯等类型的前药,另外还可制成偶氮型前药、一氧化氮型前药及开环、闭环等新型结构的前体药物[6],如图2所示。
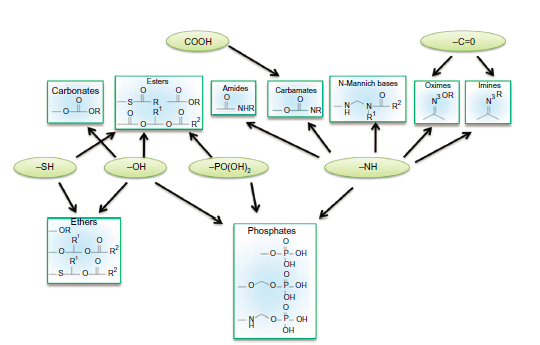
图2:前体药物中含有不同基团[7]
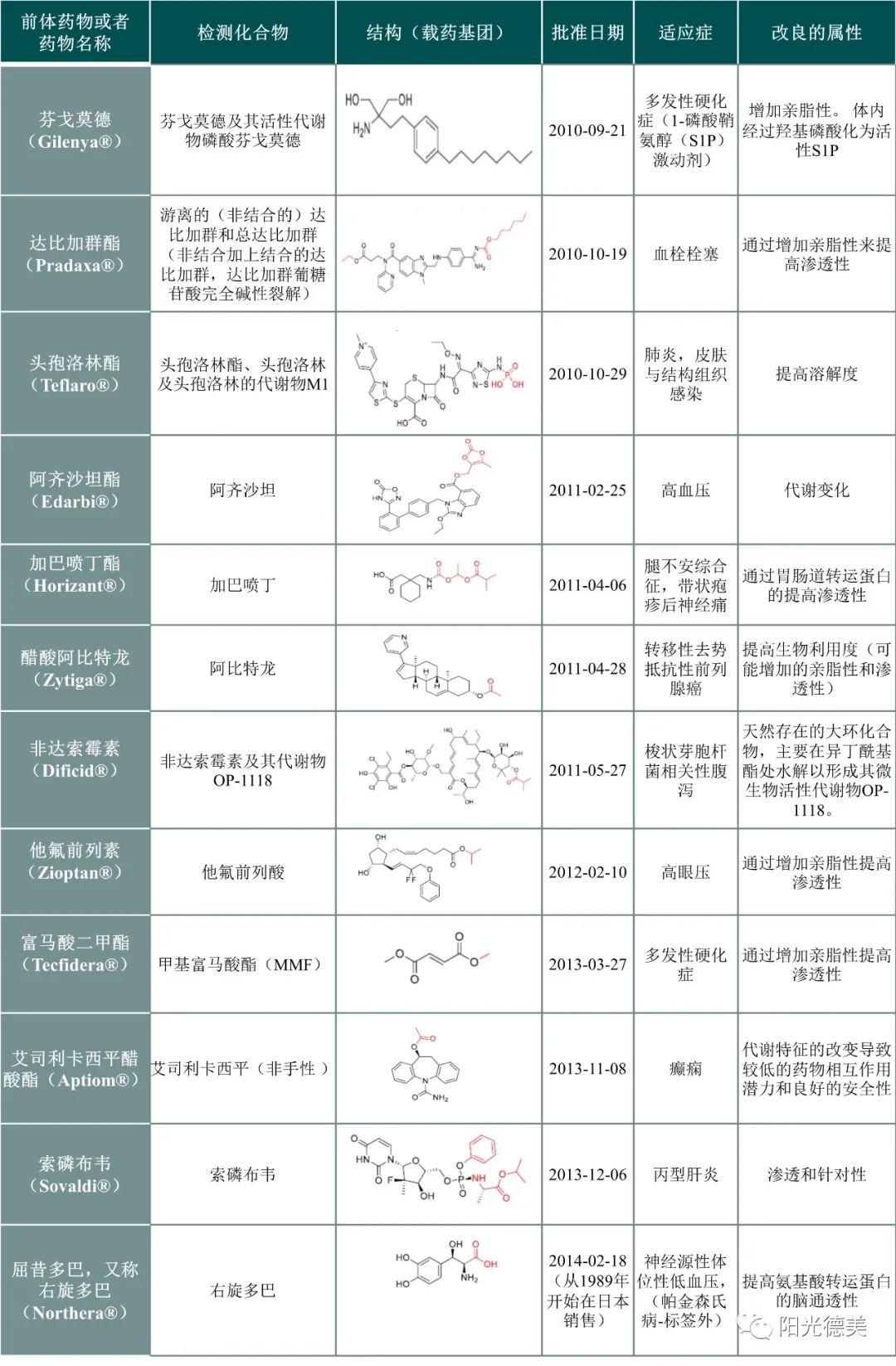
近年来由于前体药物展现出的优势,前体药物在新药研究中越来越受到人们的重视。在2010-2017年间,FDA批准的227种小分子药物中有23种可归类于前体药物,占10.1%,见表1。目前在世界范围内批准上市的药品中有5%~7%可以归类为前体药物,且已经成功地应用在神经系统药物、抗肿瘤药物、抗病毒药物等方面。
表1 FDA批准前体药物(2010~2017)[5]
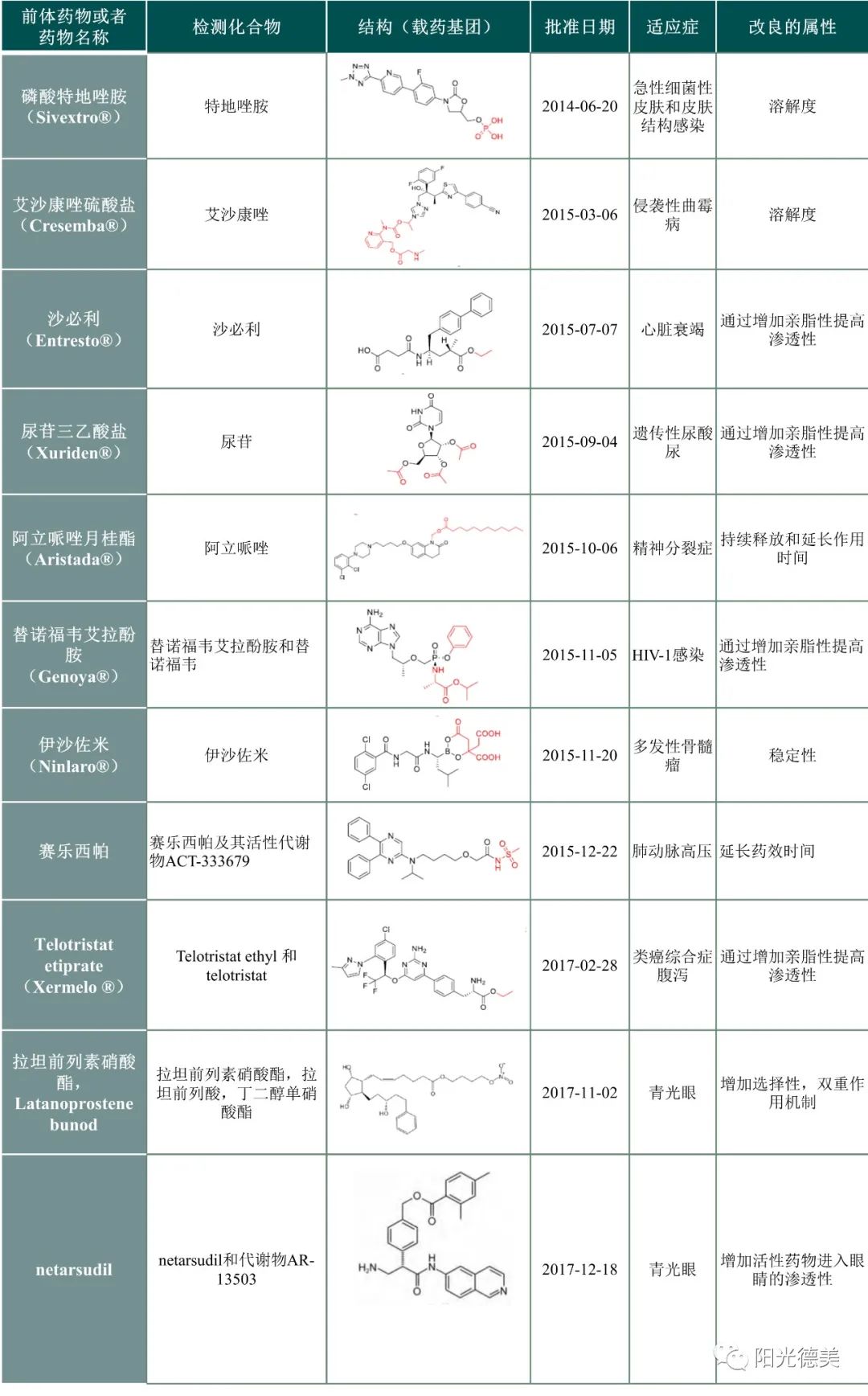
02
前体药物的体内过程
前药进入体内后要经历复杂的吸收、分布、代谢和排泄过程,见图3,前药进入全身循环后,在多个部位(例如:肠,肝,肺,肾)转化成原药(活性药物)。前药向原药的转化速率决定了体内或组织内前药和原药的暴露量[3]。
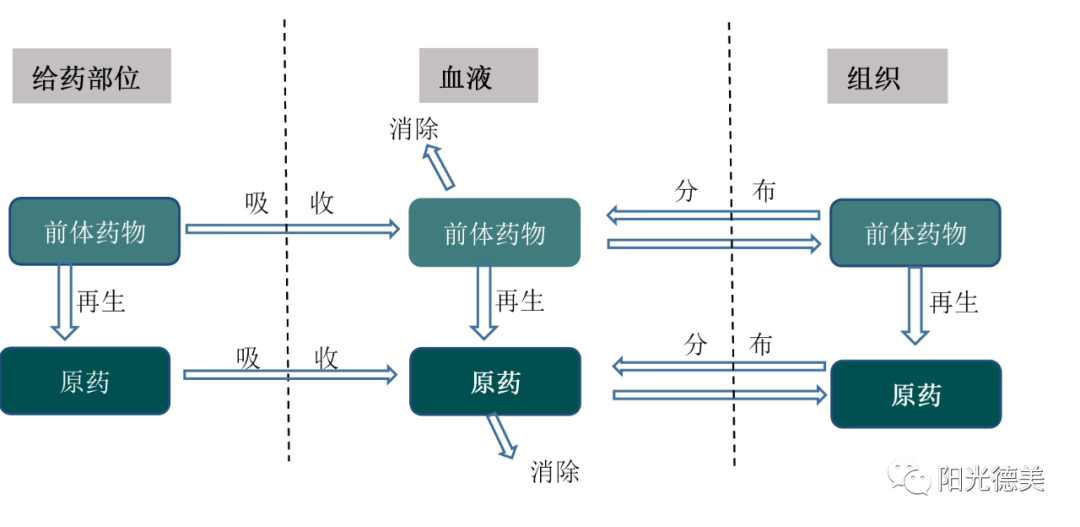
图3 前体药物的机体内过程示意图
为了在给药部位保持稳定性或改善药物的生物利用度,可通过化学结构修饰使前体药物在给药部位不转化为原药,使前体药物在吸收过程或转运至血液时迅速游离出原药。针对此类为提高口服吸收而设计的前药,理想的前药和原药的药时曲线见图4(a)。
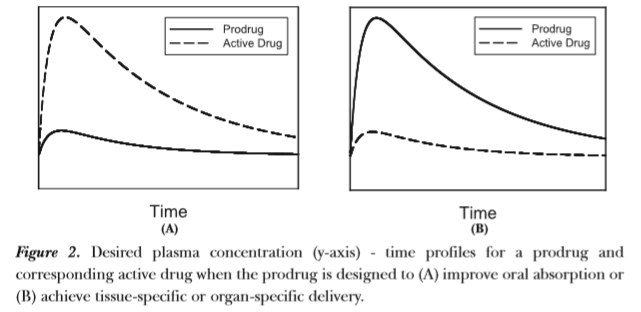
图4 期望的前体药物和原药的药时曲线[8]
为了增强对作用部位的选择定向性,要求原药在到达作用部位前,按前体药物结构转运,到达作用部位附近的组织后转化成原药发挥作用;同时前体药物最好对作用部位附近的其他组织不产生活性[3]。针对此类为实现组织特异性或器官特异性而设计的前药,理想的前药和原药的药时曲线见图4(b)。
前体药物的体内过程比较复杂,为了全面地阐明一个前药在体内的吸收、分布、代谢和排泄(ADME)的动态规律,为临床用药提供依据,需要用生物分析的手段对其进行研究。
03
前体药物的生物分析
3.1检测化合物[9]
前体药物的生物分析,首先要确定检测化合物是前体药物还是原药。国家食品药品监督管理总局发布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中指出:对于前体药物,一般推荐仅测定前体药物,因为前体药物的药时曲线比原药能更灵敏地反映制剂间的差异。对于从前体药物直接代谢产生的原药,如果同时满足以下两点,则应同时予以测定:
1)原药主要产生于进入体循环以前,如源自首过效应或肠道内代谢等;
2)原药显著影响药物的安全性和有效性。建议以前体药物评价生物等效性,原药的相关数据用于进一步支持临床疗效的可比性。如果前体药物浓度过低,不足以获得生物样品中足够长时间的药物浓度信息,则可用原药的相关数据评价生物等效性[10]。
3.1.1 仅测定前体药物
假如前体药物从制剂中释放并被完整吸收,同时其在体循环中的测定方法稳定、可靠,那么,最好的方法仍是测定前体药物。前体药物的药时曲线对制剂表现的变化比原药更加敏感,原药则更多地是反映了原药的形成、分布和消除,故测定前体药物是首选方法。例如治疗丙型肝炎的药物索磷布韦,是一种可被广泛代谢的核苷酸前体药物,在肝脏中被广泛代谢,FDA生物等效性指导原则要求只检测血浆中的索磷布韦[11]。
3.1.2 测定前体药物和原药
前体药物无活性,它在体内能快速转化成有活性的原药,且疗效和毒性主要与此原药有关,那么宜同时检测前体药物和原药,增加原药的药代动力学参数可以降低消费者替换使用药物的风险。对于有首过效应、药代动力学为非线性关系的前体药物,当缺乏药物吸收及首过效应的相关资料时,也宜同时检测前体药物和原药。FDA特殊药物生物等效性指导原则中较多的是检测前体药物和原药,并以前体药物来评价生物等效性。例如,抗病毒药磷酸奥司他韦的活性代谢产物奥司他韦酸是强效的选择性流感病毒神经氨酸酶抑制剂,在生物分析时必须同时测定血浆中的奥司他韦及其代谢物奥司他韦酸(图5)。另外很多血管紧张素转换酶抑制剂(ACEI)也是前药,例如依那普利、群多普利、贝那普利等(图5),根据FDA特殊药物生物等效性指导原则,需要同时检测前体药物和原药。
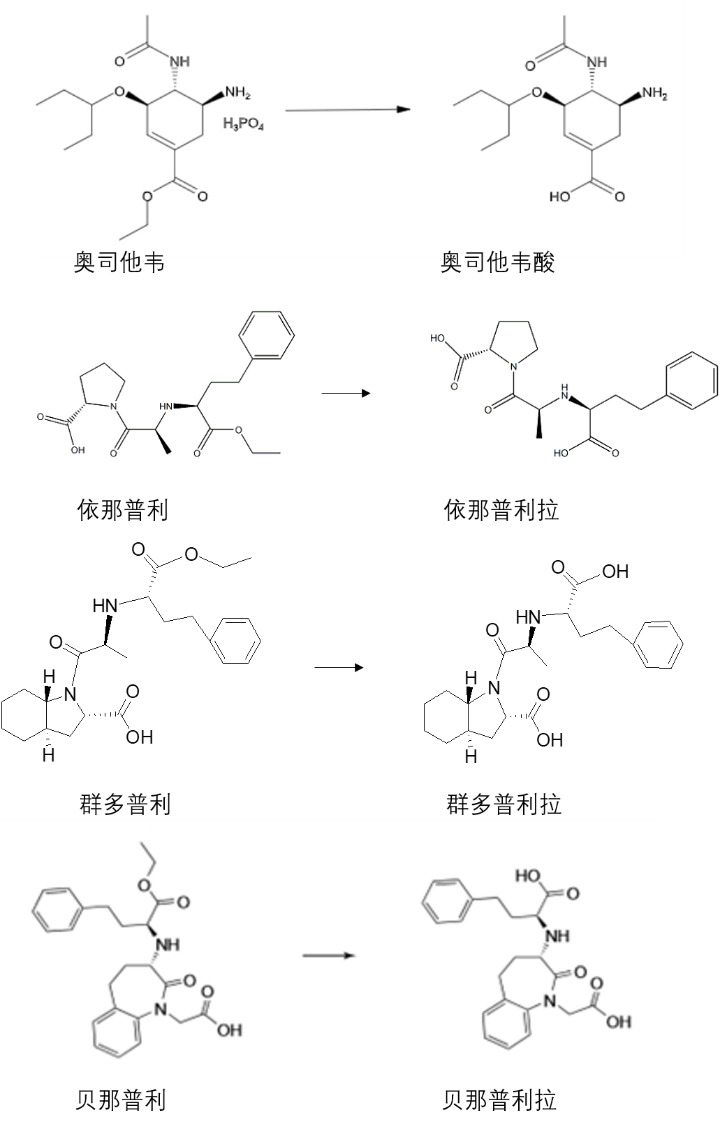
图5 前药及其活性成分
3.1.3 仅测定原药
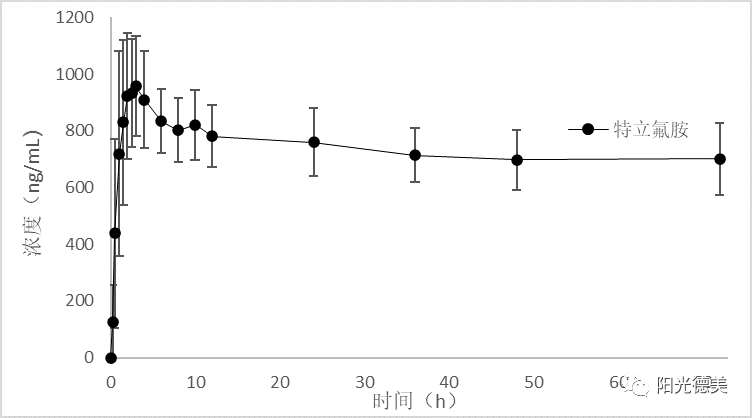
由于某种原因,如前体药物在生物基质中不稳定、快速代谢或分析方法学上有困难,无法准确测定前体药物;或者原药与药物疗效和安全性密切相关,一般认为可采用仅测定生物样品中原药浓度。另外对于无首过效应、药代动力学呈线性关系的前体药物,检测化合物为原药。例如,类风湿关节炎的药物来氟米特,在体内迅速代谢成一种主要代谢产物特立氟胺(A771726,M1)和许多次要代谢产物(图6),主要通过特立氟胺在体内发挥作用,原研药物的申报资料中显示,血浆中来氟米特的浓度极低。FDA指导原则检测血浆中的代谢产物特立氟胺(A771726,M1)。
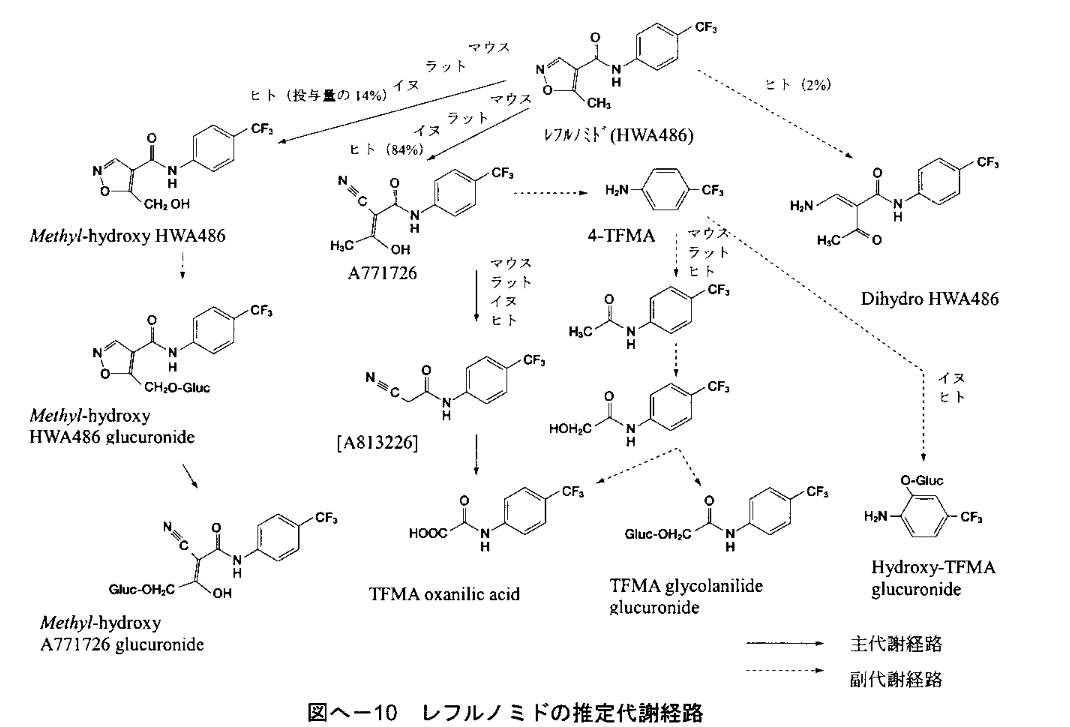
图6 来氟米特的代谢途径[12]
3.2 前体药物的生物分析面临的挑战
前体药物的生物分析是生物等效性和新药临床试验评价的关键,前体药物生物分析面临的主要挑战一是如何在定量之前的生物样品采集、处理、存储和样品制备过程中,保证前体药物在预定生物基质中稳定;二是如何同时检测化合物极性差异较大的前体药物和原药。
3.2.1前体药物的稳定性
大多数前体药物是含有酯类结构,是通过衍生化其结构中的酚基、羟基或羧基而生成。在样品的采集、处理、储存、解冻、冻融、提取、吹干、复溶等过程中,酯类前体药物易受体内多种酯酶的催化和体外水解反应,转化形成其活性化合物。从生物样品分析的角度来看,应尽量避免发生前体药物的分解,否则将影响前体药物和活性化合物的准确度。
避免前体药物分解,可以采取控制温度、选择合适的抗凝剂、pH值控制、加入酯酶抑制剂等预防措施,也可以将上述方法联合使用,来降低或抑制酯酶的活性,从而减少前体药物的转化[13]。
不过也不是所有的前体药物都不稳定,例如依那普利。依那普利是血管紧张素转换酶抑制剂,进入体内后代谢成依那普利拉而发挥作用。依那普利和依那普利拉均具有良好的稳定性(图7),不需要采取特殊的措施。
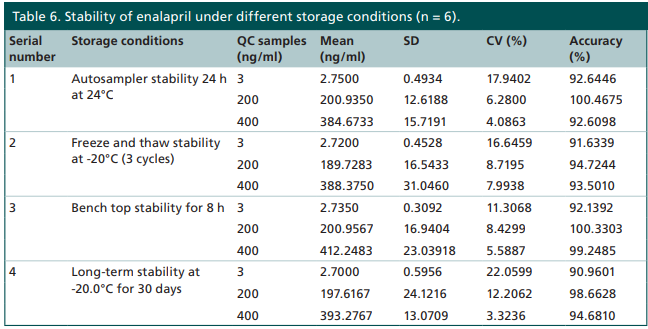
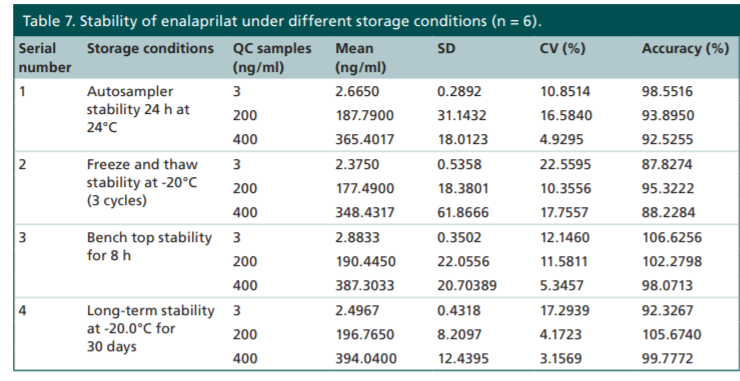
图7 依那普利和依那普利拉的稳定性数据[14]
(1)控制温度
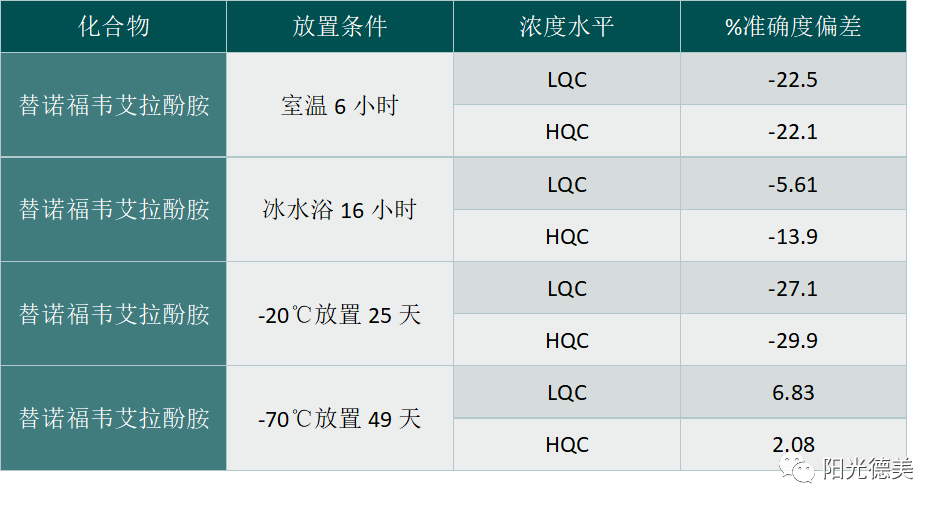
温度控制对生物样品中不稳定分析物的分析可靠性起着关键作用,低温可以降低酶的催化速率。对于不稳定的前体药物,样品处理样品宜在冰水浴(0~4℃)上进行。分离血浆时,一般在4℃低温离心,血浆样品立刻冷冻,尽可能缩短样品采集到冰箱冷冻的有效间隔。例如:替诺福韦艾拉酚胺是一种创新型、靶向性的替诺福韦的前药,用于治疗慢性乙型肝炎。含有替诺福韦艾拉酚胺的血浆样品室温放置6小时,约有20%的替诺福韦艾拉酚胺降解成替诺福韦,在冰水浴上可以放置约16小时仍稳定(表2);血浆样品-20℃条件下放置25天不稳定,-70℃放置49天稳定。
表2 替诺福韦艾拉酚胺和替诺福韦的稳定性[15]
(2)抗凝剂选择
不同抗凝剂可能会影响到化合物的稳定性。常见的抗凝剂有肝素和EDTA,两者作用机制不同,肝素作为多糖只能加速凝血酶失活。而EDTA鳌合钙离子,阻断凝血链式反应,从而抑制磷脂酶和酯水解酶的活性。因此,常用EDTA作为酯类前体药物的抗凝剂。柠檬酸也是一种常见的抗凝剂,且能调节pH,故也常用于酯类前体药物的抗凝剂。
(3)pH值控制
pH值在酸或碱催化的酶反应中发挥着重要的作用,且大多数酶反应都有一个窄的工作pH窗口。通过简单调节样品的pH值(如将pH值控制在4~5之间)可能会有效地稳定药物分子。实际上,在减少酶活性上,低的pH值比低温更有效。最常用的pH值调节剂有各种浓度的甲酸、乙酸、磷酸、柠檬酸或者缓冲液,如tris缓冲液。
(4)酯酶抑制剂
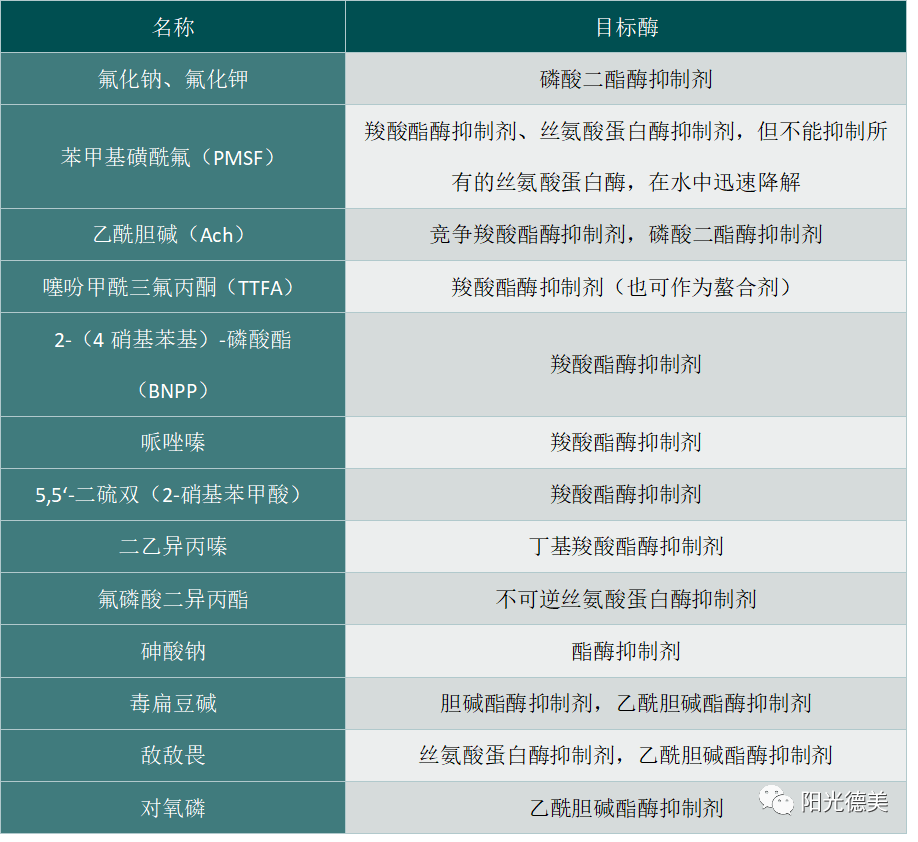
血浆是生物分析中的主要基质,其主要成分是水、血浆蛋白、葡萄糖、激素、矿物离子以及多种水解酶等。血浆中的水解酶主要有胆碱酯酶、脱氢肽酶、脂肪酶和磷酸酶等。当小分子化合物与血浆中的某种水解酶具有一定亲和力的时候, 其结构中特定的官能团就会被水解酶水解,从而导致具有生物活性的化合物在血浆中的浓度迅速降低。在血浆中容易被降解的官能团主要有酯基、酰胺、内酯、氨基甲酸酯、内酰胺、磺酰胺以及肽类结构等。有很多酶抑制剂可用来稳定前体药物和其他的酶不稳定化合物,见表3。
表3 常用的酯酶抑制剂
3.2.2极性差异
前体药物是对原药进行结构修饰,以提高药物的脂溶性或者水溶性,因此前体药物与原药的极性差异较大,在色谱柱上的行为不一致。要实现在一个方法同时检测两个化合物,对方法的要求较高。往往会出现极性较大的化合物无保留且极性较小的化合物存在残留效应,解决这些问题,需要开发合适的定量分析方法,并选择适宜的色谱柱、流动相、梯度、洗针液等。

04
生物分析方法
下面简述几个的前体药物的生物分析方法。
4.1 检测前体药物
索磷布韦
治疗丙型肝炎的药物索磷布韦口服后在肝脏中被广泛代谢,血浆中未检测到活性代谢产物,前体药物索磷布韦在全血和血浆中均较为稳定,临床样本的采集和存储不需要采取特殊的措施,HPLC-MS/MS分析时发现,索磷布韦在色谱柱上的残留较大,通过梯度洗脱能解决其残留的问题。其药时曲线如图8。
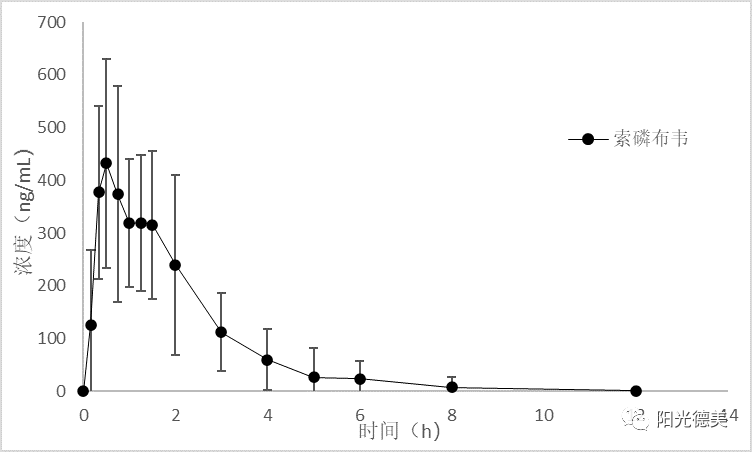
图8 索磷布韦的药时曲线图[15]
4.2 检测前体药物和原药
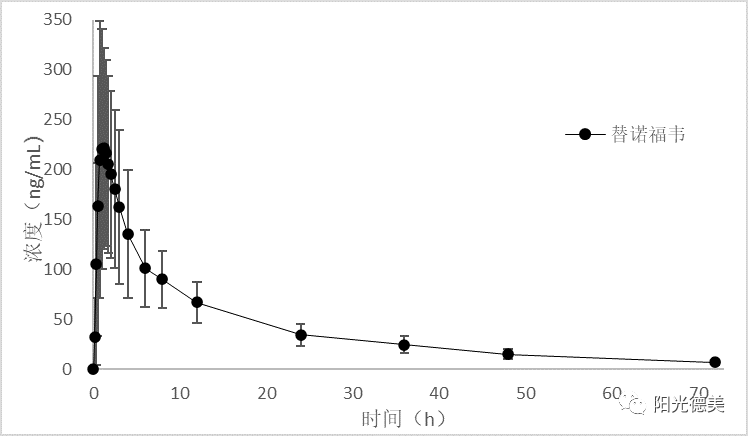
替诺福韦艾拉酚胺
替诺福韦艾拉酚胺血浆样品室温放置不稳定,控制温度能够很好的抑制替诺福韦艾拉酚胺转化为替诺福韦,所有的操作均需在冰水浴上进行。替诺福韦艾拉酚胺的半衰期(t1/2)约为0.51h,在体内4小时后几乎检测不到,替诺福韦t1/2约为44.29h,口服72小时后仍有较高的浓度。HPLC-MS/MS分析时发现,替诺福韦艾拉酚胺在液相系统上的残留较大,而替诺福韦几乎不保留,通过色谱柱的选择和调节洗脱的梯度成功的实现两个化合物的同时检测。替诺福韦艾拉酚胺和替诺福韦的药时曲线如图9。

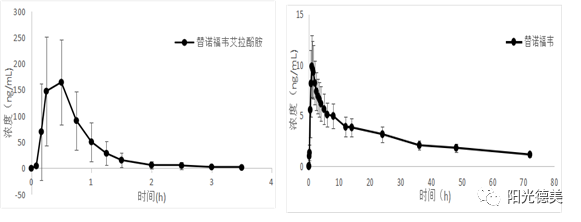
图9 口服替诺福韦艾拉酚胺片后的药时曲线图[15]
磷酸奥司他韦
磷酸奥司他韦在全血和血浆样品中均不稳定,临床上采集全血时应立即加入酯酶抑制——氟化钠(NaF),并严格控制NaF的加入量。在NaF足够的情况下能抑制奥司他韦向奥司他韦酸的转化。由于NaF的加入,血浆样品的处理过程不需要控制温度和pH值,血浆样品的室温放置、反复冻融、长期放置均较稳定。奥司他韦和奥司他韦酸的药时曲线见图10。

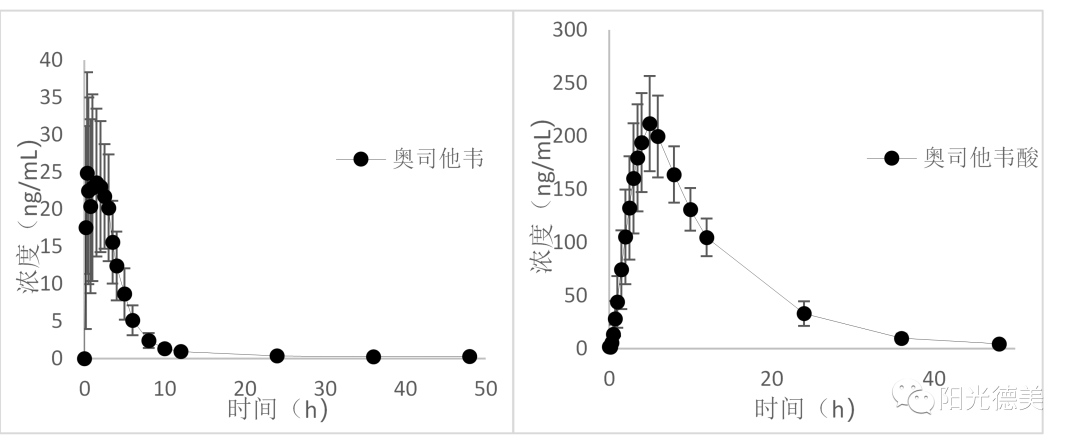 图10 磷酸奥司他韦和奥司他韦酸的药时曲线图[15]
图10 磷酸奥司他韦和奥司他韦酸的药时曲线图[15]
非索罗定
非索罗定是治疗有尿频、尿急和急迫性尿失禁症状的膀胱过度活动症,在体内非索罗定迅速的代谢成为5-HMT(5-羟甲基托特罗定)。FDA原研药的申报资料中显示,血浆中几乎检测不到非索罗定的浓度(低于0.0100ng/mL,图11左),5-HMT在体内发挥作用。有文献报道,通过添加焦亚硫酸钠和盐酸能够使非索罗定保持稳定,阳光德美建立了同时测定血浆中的非索罗定和5-HMT浓度的分析方法,全血采集和血浆样品处理均需要在冰水浴上操作,且全血样品采集后立即加入焦亚硫酸钠,分离血浆后立即加入盐酸,可以保持血浆中非索罗定和5-HMT的稳定。但是由于血浆中几乎检测不到非索罗定,故用5-HMT来进行生物等效性的评价。口服非索罗定片后的药时曲线见图11。

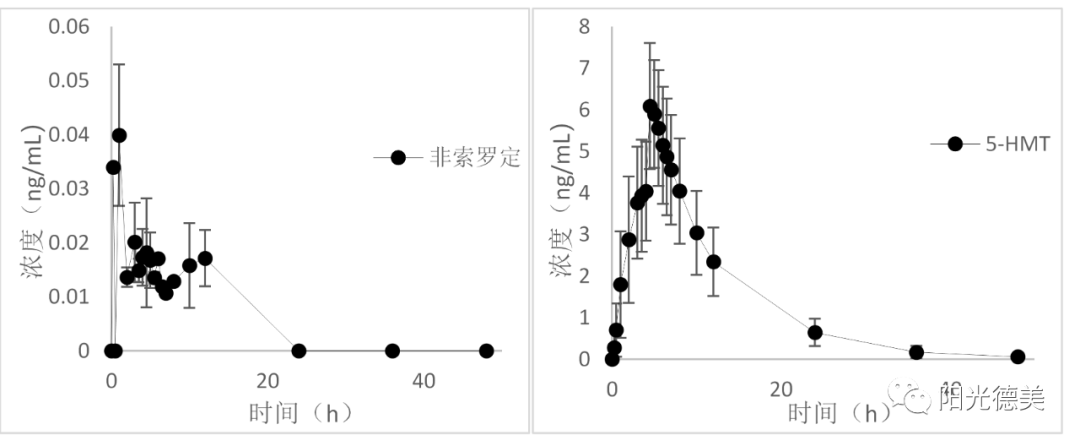
图11 非索罗定和5-HMT的药时曲线图[15]
依那普利、贝那普利
依那普利、贝那普利是血管紧张素转换酶抑制剂,口服后在肝脏水解为具有活性的依那普利拉、贝那普利拉后发挥作用,前体药物和原药均稳定,不需要采取特殊的措施。药时曲线图如图12、图13。

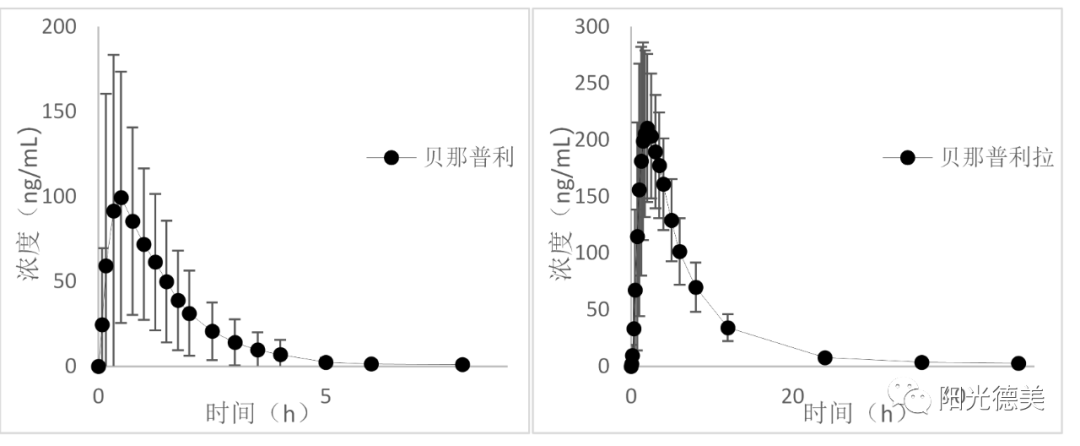
图12 贝那普利和贝那普利拉的药时曲线图[15]

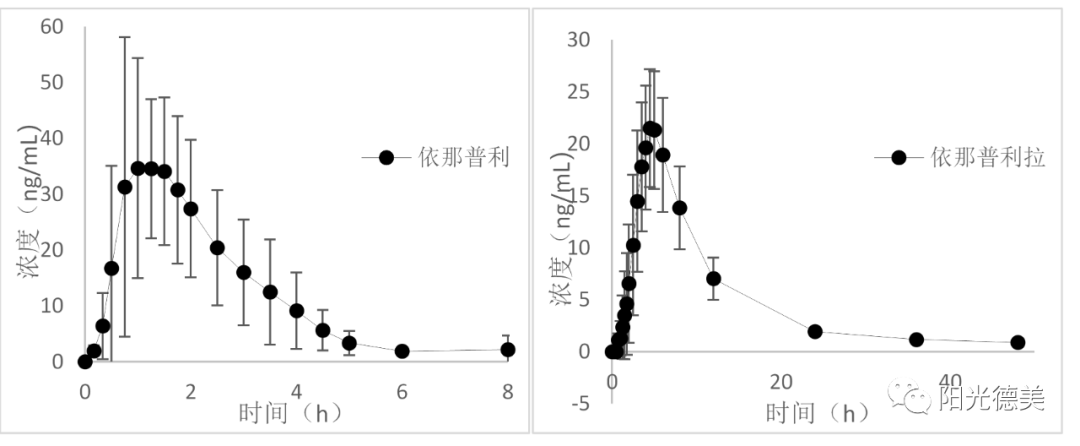
图13 依那普利和依那普利拉的药时曲线图[15]
4.3 只检测原药
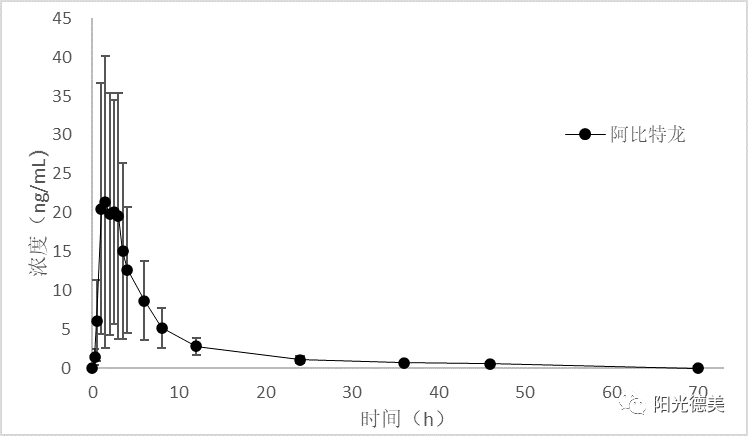
来氟米特、醋酸阿比特龙、替诺福韦二吡呋酯
来氟米特、醋酸阿比特龙、替诺福韦二吡呋酯进入体内后迅速水解,在体内几乎检测不到前体药物,血浆中的活性代谢产物特立氟胺、阿比特龙、替诺福韦用于生物等效性评价,三个活性代谢产物在基质中均稳定,临床样品的采集、存储及处理不需要特殊的操作。HPLC-MS/MS分析方法仅检测一个化合物,较简单。


前体药物的发展改善了药物的吸收、生物利用度及稳定性等方面的缺陷,提高药物的疗效,降低其毒副作用。前体药物在新药研发和临床应用中将发挥越来越重要的作用,已成为优化药物给药系统,提高靶向性作用,增强治疗效果的重要手段。开展前体药物的药代动力学研究和生物分析,对进一步了解药物在体内吸收、分布、代谢和排泄过程,最大限度地发挥药效和降低毒副作用,指导临床合理用药,具有重要的理论和实践意义。
素材来源:阳光德美



