ELISpot/FluoroSpot技术在生物分析中的应用

01
ELISpot/FluoroSpot技术原理
ELISpot(Enzyme-linked ImmunoSpot Assay)全名为酶联免疫斑点检测,在酶联免疫吸附技术(即ELISA)的基础上结合了细胞培养技术。ELISpot捕获的目标来自于包被板中培养的细胞在刺激下新鲜分泌的蛋白(抗体或者细胞因子等),去除细胞后,通过酶促反应放大效应展现出有色斑点。ELISpot是一种高度敏感的免疫检测技术,可在单细胞水平检测分泌细胞的频率,从而可以对样本中活细胞免疫状态进行动态的监测评估。
FluoroSpot技术是ELISpot技术的进阶,通过荧光团而不是酶和底物组合对斑点进行可视化,从而改进了双酶联斑点的检测。FluoroSpot技术将不同发射波长的荧光团混合在一起,只要加一张滤光片,就可以精确的滤出目标荧光,而遮蔽掉其它颜色荧光,荧光之间可以互不干扰。这对于双因子,甚至多因子ELISpot检测都是十分理想的手段[1]。
02
ELISpot/FluoroSpot技术实验流程
ELISpot/FluoroSpot技术简要的实验流程如图1所示:
(1)单克隆包被抗体加入乙醇预混的PVDF膜96孔板中进行包被;
(2)接种细胞并加入相应的刺激物进行孵育;
(3)分泌的蛋白(抗体或者细胞因子等)被包被抗体捕获;
(4)去除细胞,加入相应的检测抗体(ELISpot为生物素标记抗体,FluoroSpot为荧光标记抗体或Tag标签标记抗体);
(5)加入酶偶联链霉亲和素(ELISpot)/加入抗标签的荧光标记抗体(FluoroSpot);
(6)加入底物,在酶促作用下显色斑点(ELISpot)/在激发光的作用下检测发射光(FluoroSpot)。
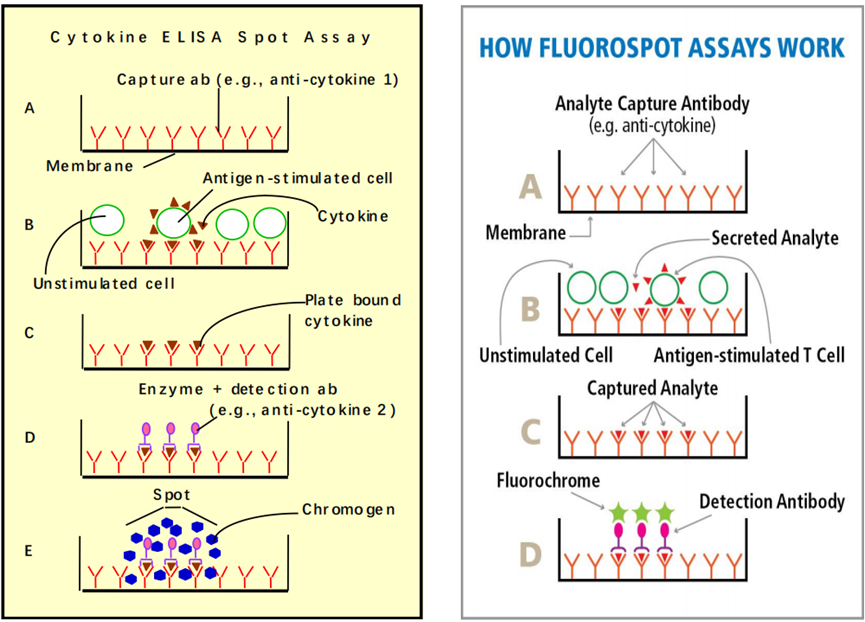
图1:ELISpot/FluoroSpot技术简要的实验流程
03
ELISpot/FluoroSpot技术优势
高灵敏度
ELISpot理论上可达到百万分之一的灵敏度,也就是说,在一百万个细胞中只要有一个分泌细胞因子的阳性细胞就能检测出来。实际中,由于考虑到细胞在孔的底部形成单层而不堆积,一般96孔板中最多铺40~60万个细胞/孔,所以实际中ELISpot也可以达到几十万分之一的级别。比传统的ELISA方法和流式方法(细胞内细胞因子染色法ICS)高2~3个数量级,是目前为止最为灵敏的免疫检测技术。
单细胞水平
ELISpot技术为一种单细胞水平、活细胞功能检测。检测的是单个细胞分泌,而非细胞群体的平均分泌,对研究生物体的细胞免疫和细胞功能提供有效的检测策略。也就是说,ELISpot这种基于单细胞水平的检测可以提供更多的免疫信息。
功能性检测
ELISpot检测是动态的免疫检测,斑点代表分泌细胞在一段时间内的分泌动态,即“Footprint”。斑点的强弱和数量反映了细胞对刺激物的反应能力和分泌细胞因子的动态能力,这是体现细胞免疫反应最重要的功能指标。而ELISA只能检测细胞已分泌到上清中的遗留物,只能间接的反映细胞功能;流式细胞内细胞因子染色法ICS是把本该分泌出来的细胞因子人为的固定在细胞内,从而反映细胞应对刺激产生细胞因子的能力,而不能真实的反应检测细胞的免疫状态和分泌细胞因子的能力。
高通量检测
ELISpot整个流程基于96孔微孔板,适用于高通量实验和筛选[2]。
FluoroSpot技术可以说是ELISpot技术的进阶,其优势非常明显,除了具有ELISpot的优势外,还能实现在同一孔中对单细胞分泌的多种细胞因子进行同时检测,更节省时间、样本,更好的保证样本批次的一致性。更重要的是能够分辨仅分泌单因子、分泌双因子或三因子甚至四因子的细胞,结合多种因子的分泌更准确地对细胞的亚群进行鉴定,实现细胞群体的多功能性分析。
04
ELISpot/FluoroSpot技术应用
基于ELISpot/FluoroSpot技术的高灵敏度、高通量、单细胞水平、功能检测等优点,广泛应用于免疫学研究和临床应用,例如疫苗的研发和临床评估,基因与细胞治疗、器官移植评估等。
疫苗的研发和临床评估
早在2003年发布的《预防用DNA疫苗临床前研究技术指导原则》中指出“在评价细胞免疫效价时,应当建立检测评价细胞免疫的方法(如特异性CTL反应的方法或Elispot方法等)”。而2020年CDE发布的《新型冠状病毒预防用mRNA疫苗药学研究》指导原则中也强调了mRNA疫苗的质量研究需要进行体内效力试验,推荐使用ELISpot技术检测评价mRNA疫苗的细胞免疫反应。
ELISPOT是一种高度敏感的检测方法,可检测体外抗原刺激后PBMC中单个细胞释放的细胞因子。最常测量的细胞因子是IFN-γ ,其可由CD4+(Th1)和CD8+(细胞毒性)T细胞分泌。根据起始细胞(完整PBMC或CD4细胞耗尽的PBMC)和用于刺激的抗原(全蛋白、活的或灭活/杀死的病毒、肽),该测定可用于测量由CD4+和/或CD8+T细胞分泌的IFN-γ。并且可进一步比较CD4和CD8T细胞的特异性细胞免疫应答。在健康供体中,大多数抗原特异性T细胞的百分比通常低于1:100000 PBMC的检测限。然而,在病毒感染期间或疫苗接种后,存在于外周的抗原特异性T细胞的百分比会显著增加。因此,免疫或感染后特异性T细胞前体频率的增加将表明疫苗/病原体诱导的阳性免疫应答。ELISpot技术已经成为评价疫苗细胞免疫反应最有效的指标[3]。
新型冠状病毒肺炎是一种由新型冠状病毒引发的肺部炎症,新冠疫苗是预防新冠的最有效方法,目前多款疫苗已上市或进入临床试验阶段。据报道随着新突变株的出现,出现了中和抗体逃逸的现象,但是细胞免疫非常稳定;而且随着时间的推移,体液免疫(中和抗体)有所下降,但是细胞免疫非常强大且稳定。因此抗体至关重要,T细胞免疫功能的评估也是至关重要的。由中国工程院陈薇院士团队和康希诺生物公司(CanSino Biologics)共同研发的腺病毒5型载体(Ad5)新冠病毒疫苗在I-III期临床以及雾化腺病毒5型载体(Ad5)新冠病毒疫苗I期临床实验中采用ELISpot技术评估细胞免疫应答,进行验证免疫原性和安全性[4],如图2所示。
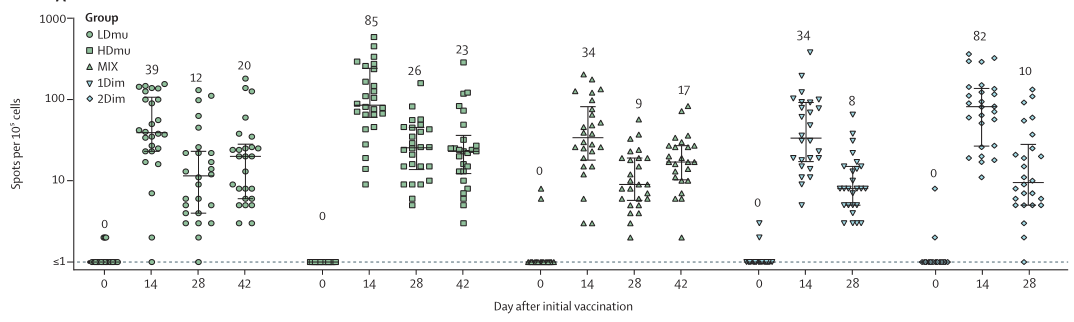
图2:雾化腺病毒5型载体(Ad5)新冠病毒疫苗I期临床ELISpot实验
考虑到一些无症状病毒接触病例与无血清转化的细胞免疫应答相关,表明在缺少中和抗体的情况下SARS-CoV-2特异性T细胞可能与疾病控制相关[5]。BioNTech和辉瑞共同研发的mRNA疫苗(BNT162b1,BNT162b2)采用ELISpot技术进行细胞免疫药效学评估以及疫苗诱导免疫原性分析[6, 7],如图3所示。
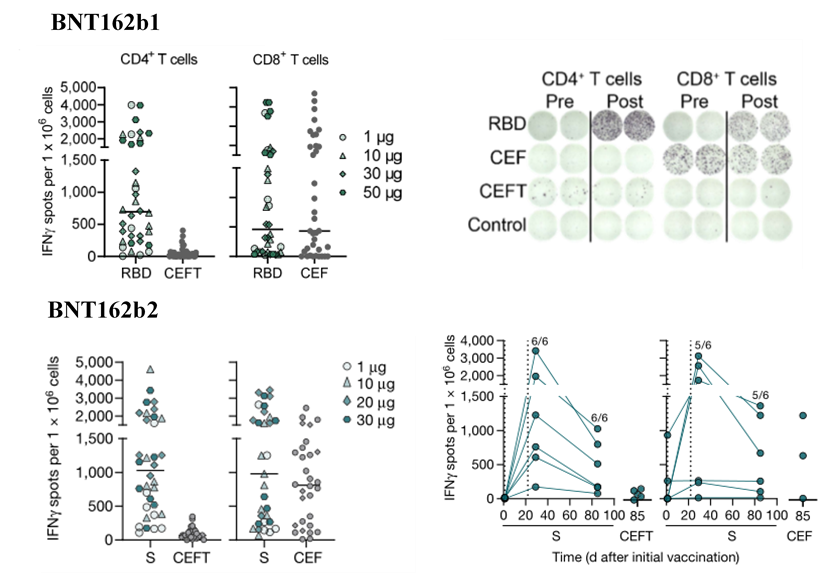 图3:mRNA疫苗ELISpot实验
图3:mRNA疫苗ELISpot实验
在流感疫苗中利用免疫斑点平台的高灵敏度,将其与荧光团标记的抗细胞因子抗体结合(FluoroSpot),在单细胞水平上同时测量IFN-γ和IL-2分泌,以评估pH1N1的异亚型记忆T细胞的功能性细胞因子特征,并进行深入的探索研究。其中发现未感染H1N1的成年人具有很高的预先存在的、循环的pH1N1特异性仅分泌IFN-γ 的CD8+效应记忆T细胞[8],如图4所示。

图4:pH1N1的异亚型记忆T细胞FluoroSpot实验
灭活流感疫苗主要通过诱导菌株特异性抗体来提供保护性免疫。由于持续的抗原漂移和偶尔的变化,迫切需要能够诱导更广泛保护的疫苗。历史证据表明,在缺乏流感特异性抗体的情况下,流感特异性CD8+和CD4+T细胞在从流感感染恢复中发挥重要作用[9, 10]。减毒流感活疫苗LAIV诱导的系统性T细胞对漂移菌株具有交叉反应性的概念,提供了潜在的临床保护。研究了专注于局部扁桃体组织中的早期T细胞反应,以研究LAIV是否在扁桃体中诱导交叉反应性CD8+T细胞。研究了接种LAIV后扁桃体和外周血单个核细胞(PBMC)中的菌株特异性T细胞反应以及扁桃体中交叉反应性CD4+和CD8+T细胞应答[11],如图5所示。
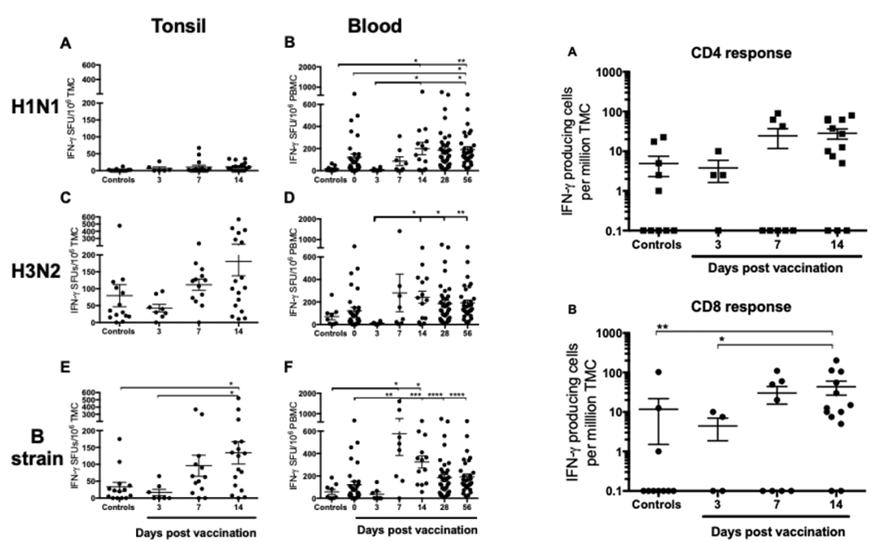
图5:LAIV疫苗ELISpot实验
基因与细胞治疗
癌症的发生与发展是机体细胞免疫机能减弱的结果,增强机体针对癌细胞的特异性细胞免疫反应是癌症治疗的重要措施之一。在介导肿瘤免疫治疗中,T细胞被公认具有举足轻重的地位。ELISpot和FluoroSpot技术可以检测肿瘤抗原特异性T细胞的诱导,并通过检测细胞毒性T细胞释放的颗粒酶B或穿孔素来表征细胞介导的细胞毒性机制。ELISpot和FluoroSpot技术通常可用于评估癌症疫苗的功效,也可用于鉴定特定的肿瘤抗原。在癌症研究中使用ELISpot不仅可以评估T细胞,也可评估B细胞用于监测癌症疫苗诱导的抗体反应的质量和持续时间。多发性骨髓瘤治疗后的高复发率仍然是一个未解决的问题。免疫疗法,尤其是CAR-T疗法,由于其非交叉耐药机制,被认为是治疗这种恶性肿瘤的最有希望的策略[12]。然而,即使在CAR-T治疗后,患者最终也会复发。因此,针对不同靶点的联合治疗可能是一种合理的策略。一些研究在使用自然杀伤细胞、细胞毒性T淋巴细胞和T细胞受体转基因T(TCR-T)细胞联合治疗骨髓瘤方面取得了突破。通过人IFN-γ ELISpot 实验鉴定出AKAP4中最强的CTL表位,该表位可用于开发癌症疫苗或T细胞受体转基因T细胞(TCR-T)以杀死骨髓瘤细胞[13],如图6所示。
 图6:AKAP4 人IFN-γ ELISpot 实验
图6:AKAP4 人IFN-γ ELISpot 实验
以AAV病毒为载体的基因治疗,在给病人治疗中,理论上没有已知的相关病理,但在实际应用中可能会导致意外的免疫反应,这可能会降低治疗效率,并可能会带来安全风险。通过ELISPOT的技术评估病毒载体在人体是否能引起T细胞免疫反应是临床阶段评估基因治疗安全性重要的指标参数。基于治疗的发展阶段,生物分布、脱落和免疫原性已成为非临床和临床开发基因疗法安全性评估的重要组成部分[14]。
器官移植
ELISpot检测可以提供器官移植前后受者免疫反应的有价值信息,在预测同种异体移植排斥反应风险和发生率及存活率方面具有重要的临床意义。受者和器官供体之间人类白细胞抗原(HLA)和其他多态性抗原系统的差异导致器官移植后发生同种异体排斥反应。预测受者对移植器官的免疫反应可使用个体化免疫抑制方案减少排斥反应的发生率。酶联免疫吸附斑点(ELISpot)测定法因其通过评估T淋巴细胞反应性预测排斥反应的能力而受到广泛研究。Hricik et al. (2003)第一个注意到阳性IFN-γ ELISpots与HLA错配数量之间正相关的趋势。Tung TH et. al., (2005)用ELISPOT监视患者体内的免疫排斥反应,可以有针对性的用药,避免盲目的使用免疫抑制剂。Slavcev et al.(2015)观察到IFN-γ分泌细胞的频率与HLA错配的数量之间存在明显的关系。Luque(2018)记录了一种B细胞FluoroSpot分析,该分析能够列举来源于循环供体反应性记忆B细胞的多种HLA特异性抗体分泌细胞。有助于指导新的治疗方法,并提供移植前后受者免疫反应的临床相关数据[15]。
05
总结
随着ELISpot/FluoroSpot技术的成熟,以及越来越多的标准化试剂、材料、仪器的加入,使得此技术方法在实验室间的应用得到稳定性和标准化的保障。相关的行业内白皮书指导也有助于增强检测方法的科学性、标准化和规范化,使得ELISpot/FluoroSpot技术运用到更多的生物医药生物分析中。

阳光德美在2019年开始建立肽类药物、核酸类药物以及RSV、AAV病毒载体药物的PK、PD、ADA研究服务平台,从软硬件建设,人员团队能力建设,质量体系建设,项目管理等多维度下功夫,目前已成功开发并实际应用I期临床研究中多种肽类药物方法、反义核酸药物方法,包括在胰岛素类药物的生物分析方面有着丰富的经验。目前在肽类药物及核酸类药物方面服务于国内胰岛素头部企业,国内大型综合型药企的核酸平台品种及多家新型Biotech肽类企业。阳光德美一直秉持着“质量是阳光德美的立身之本,效率是阳光德美的强身之道”的信念。在未来的发展中,阳光德美将一如既往地以科学、高效、准确的精神为指导,领先行业、创誉中外,与社会各界朋友精诚合作,携手奋进,共创生物样品分析领域更加辉煌的明天。
上下滑动查看文献