国家药监局及直属单位药品相关数据信息一周集锦(2022-09-05至2022-09-10)


目录
☆一、NMPA政策文件发布征求类:
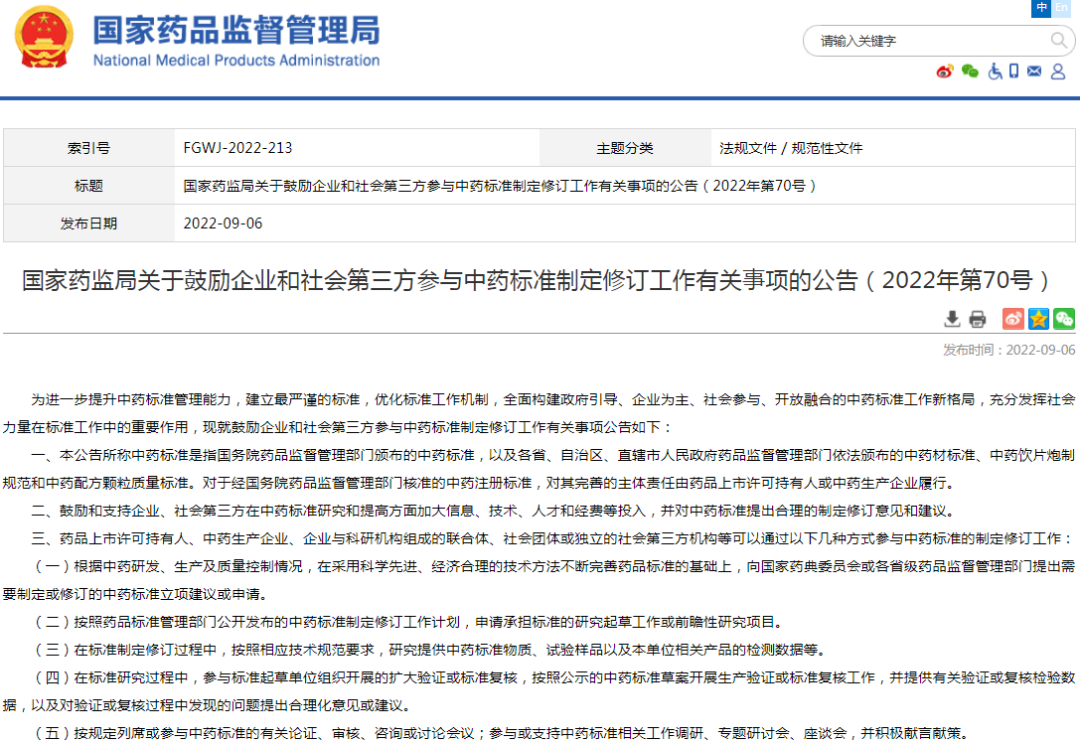
★1、国家药监局关于鼓励企业和社会第三方参与中药标准制定修订工作有关事项的公告(2022年第70号)
★2、国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见
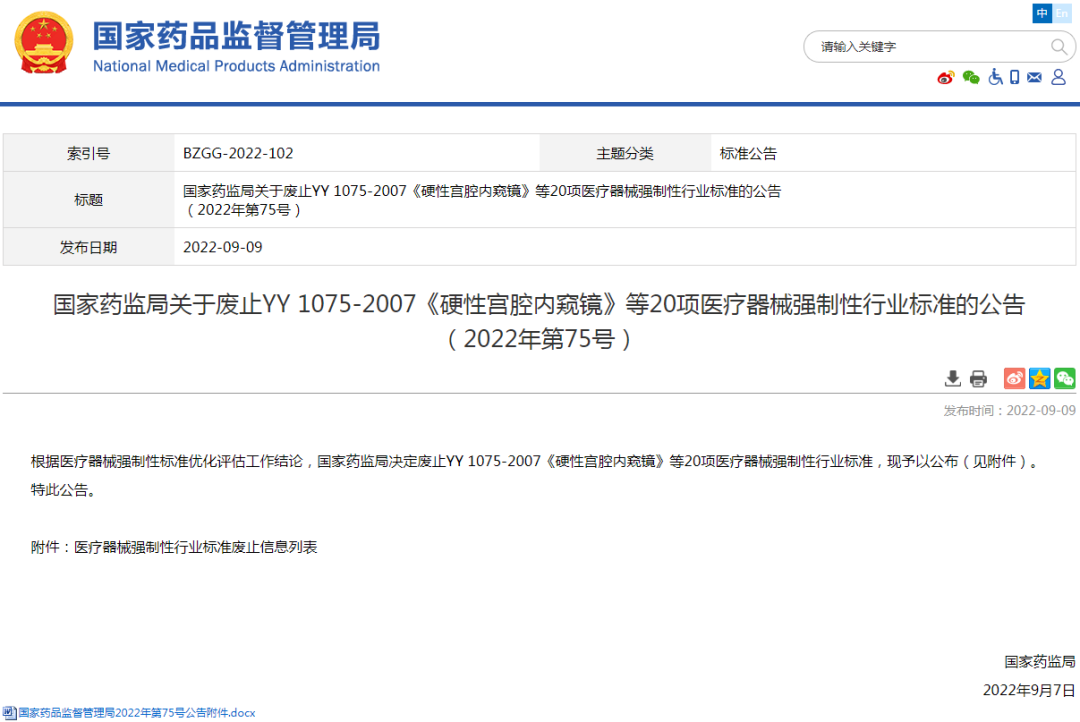
★3、国家药监局关于废止YY 1075-2007《硬性宫腔内窥镜》等20项医疗器械强制性行业标准的公告(2022年第75号)
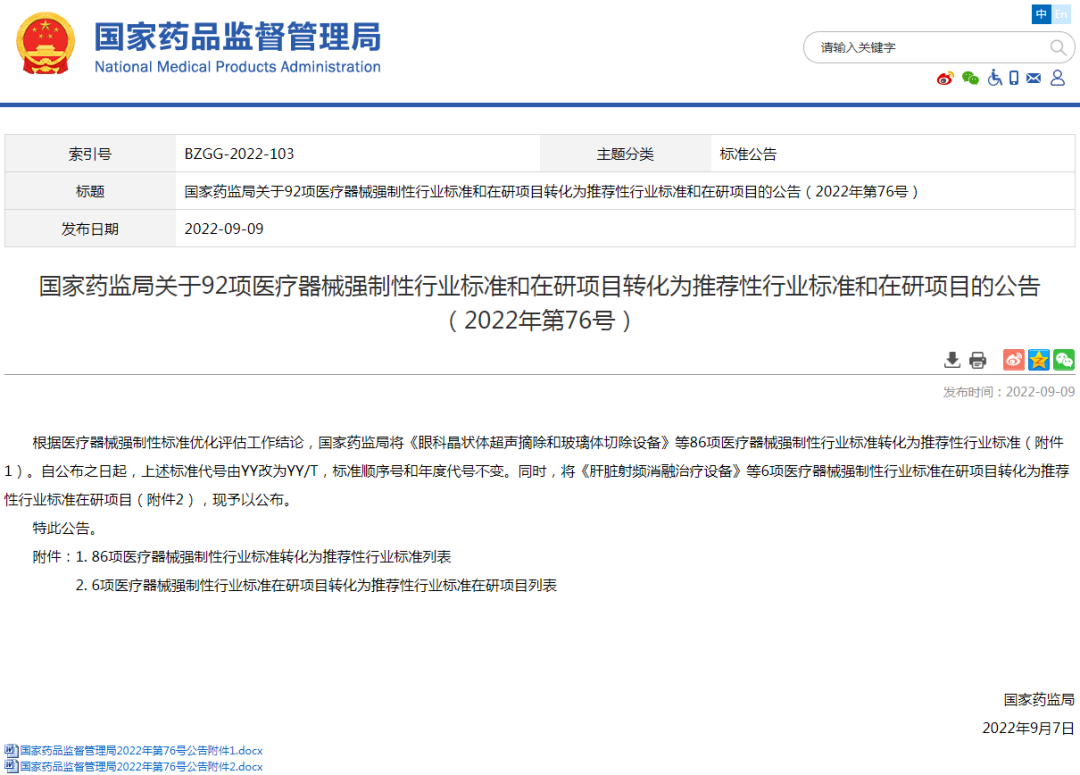
★4、国家药监局关于92项医疗器械强制性行业标准和在研项目转化为推荐性行业标准和在研项目的公告(2022年第76号)
☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△新医疗器械上市批准信息公示:本周无。
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布五十七批。
▲3、说明书修订信息:修订羟乙基淀粉类注射剂说明书
▲4、药品批准证明文件待领取信息发布:
△2022年9月6日
△2022年9月9日
▲5、药品通知件待领取信息发布:
△2022年9月6日
△2022年9月9日
▲6、药品批准证明文件(纠错)待领取信息:本周无。
▲7、中药品种保护信息公示:淫羊藿总黄酮胶囊(首家中药二级保护)、舒肝解郁胶囊(首家中药二级保护),保护期限自2022年9月5日起七年。
▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、关于公开征求《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》意见的通知
◆2、关于公开征求《复方药物临床试验技术指导原则(征求意见稿)》意见的通知
◆3、关于公开征求ICH《Q3D(R2):元素杂质指导原则》实施建议和中文版的通知
◆4、关于公开征求《化药口服固体制剂连续制造技术指导原则(征求意见稿)》意见的通知
☆四、CDE新承办信息公示类
■1、境内企业新药申报承办情况统计
■2、进口申报承办情况统计:
■3、境内企业仿制药申报承办情况统计:
■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
□(4)进口改变处方工艺的一致性评价:本周无。
■5、原料药登记信息公示:
■6、药用辅料登记信息公示:
■7、药包材登记信息公示:
☆五、CDE信息公示类
●1、临床试验默示许可:新增86条,共计8075条
●2、优先审评公示
○(1)拟优先审评品种公示:本周无。
○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
○(1)拟突破性治疗品种公示:CMG901、YK-029A片
○(2)纳入突破性治疗品种:AK112注射液、注射用STSP-0601、Teclistamab 注射液
○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周无新增,第六十二批公示期限:2022年8月30日~2022年9月13日(10个工作日),公示共计六十二批
●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
●8、上市药品信息:新增7条,涉及5个品种为:替雷利珠单抗注射液、特瑞普利单抗注射液、阿立哌唑口溶膜、注射用紫杉醇聚合物胶束、重组甘精胰岛素注射液,信息公示共计959条
○(1)2022年09月06日:新增6条,涉及4个品种为:替雷利珠单抗注射液、特瑞普利单抗注射液、阿立哌唑口溶膜、注射用紫杉醇聚合物胶束
○(2)2022年09月08日:新增1条,涉及1个品种为:重组甘精胰岛素注射液
☆六、CMDE发布公示信息:
∮关于公开征求《液相色谱串联质谱系统注册审查指导原则》等2项医疗器械注册审查指导原则意见的通知
☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:
¢关于举办医疗器械生产企业质量体系实务培训班的通知
¢关于举办2022年第二期药物临床试验注册核查交流会的通知
☆九、CHP发布公示信息:
⊙关于鼓励参与塑料类药包材标准调研的通知
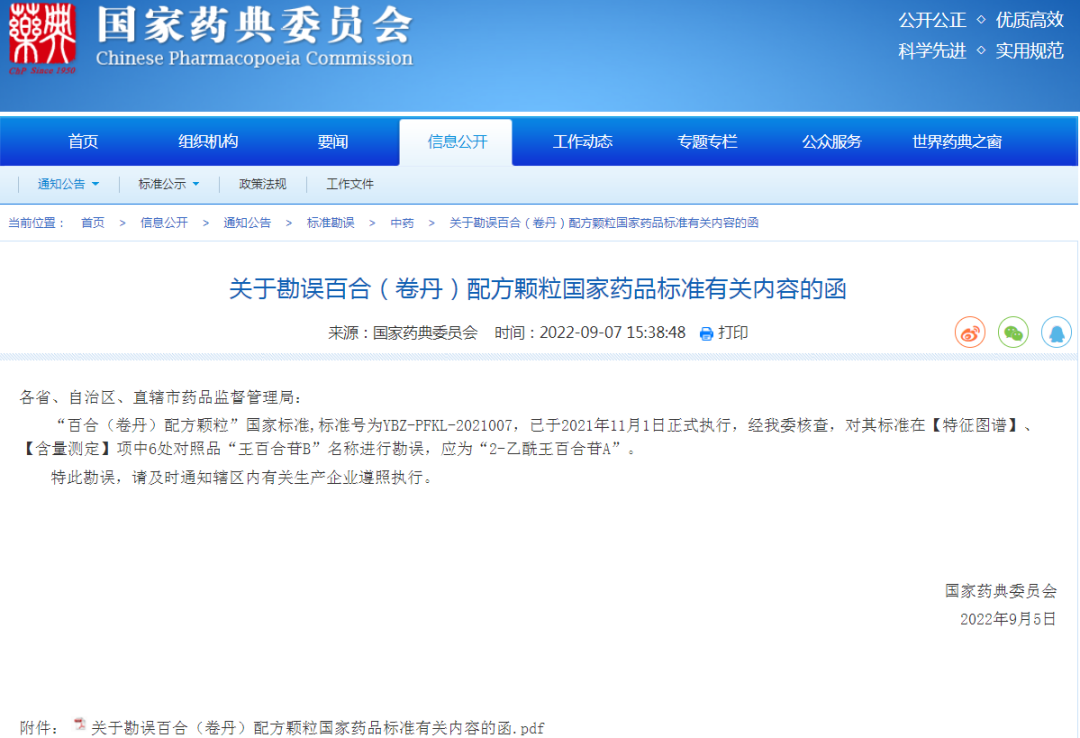
⊙关于勘误百合(卷丹)配方颗粒国家药品标准有关内容的函
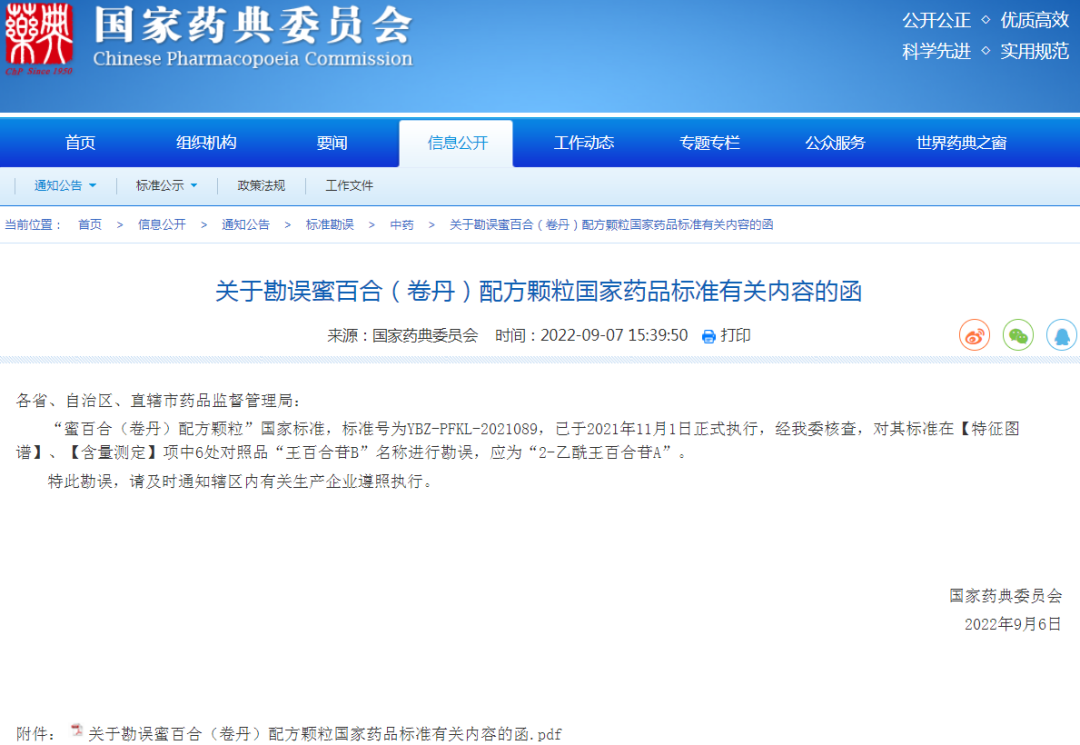
⊙关于勘误蜜百合(卷丹)配方颗粒国家药品标准有关内容的函
⊙标准公示——中药配方颗粒国家标准申报资料受理及审评情况的公示(第六期)、胰酶肠溶胶囊、胰酶肠溶片、格列美脲、泼尼松、赖氨酸磷酸氢钙颗粒、厄贝沙坦、盐酸氮芥、盐酸多沙普仑、盐酸赛洛唑啉、托吡卡胺、盐酸环丙沙星、盐酸特比萘芬国家药品标准草案的公示
☆十、NIFDC发布公示信息:本周无。
☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:
§国家市场监督管理总局食品审评中心关于举办2022 年度第二次婴幼儿配方乳粉产品配方注册宣贯会的通知
☆十三、CNCSDR发布公示信息:
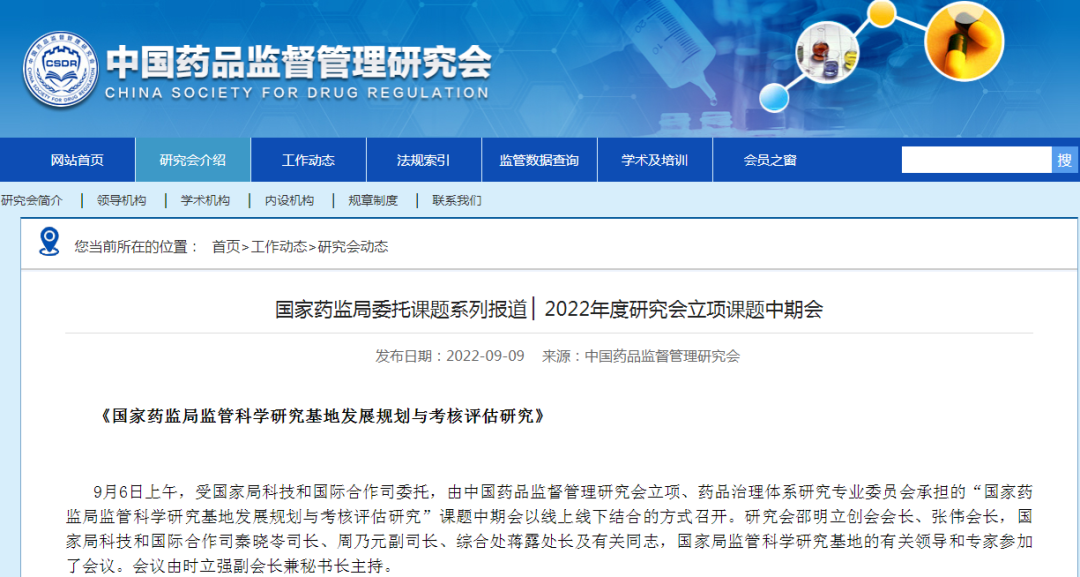
¤国家药监局委托课题系列报道 ▏2022年度研究会立项课题中期会
¤课题系列报道 ▏2021年度研究会立项课题结题会
☆一、NMPA政策文件发布征求类:
★1、国家药监局关于鼓励企业和社会第三方参与中药标准制定修订工作有关事项的公告(2022年第70号)

链接:
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220906155144186.html

★2、国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见

链接:
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20220909171207137.html

★3、国家药监局关于废止YY 1075-2007《硬性宫腔内窥镜》等20项医疗器械强制性行业标准的公告(2022年第75号)
链接:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxhybzhgg/20220909154311153.html

★4、国家药监局关于92项医疗器械强制性行业标准和在研项目转化为推荐性行业标准和在研项目的公告(2022年第76号)
链接:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxhybzhgg/20220909154942114.html

☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△新医疗器械上市批准信息公示:本周无。
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布五十七批。
▲3、说明书修订信息:修订羟乙基淀粉类注射剂说明书

链接:
https://www.nmpa.gov.cn/xxgk/ggtg/ypshmshxdgg/20220906104548135.html

▲4、药品批准证明文件待领取信息发布:
△2022年9月6日

△2022年9月9日

▲5、药品通知件待领取信息发布:
△2022年9月6日
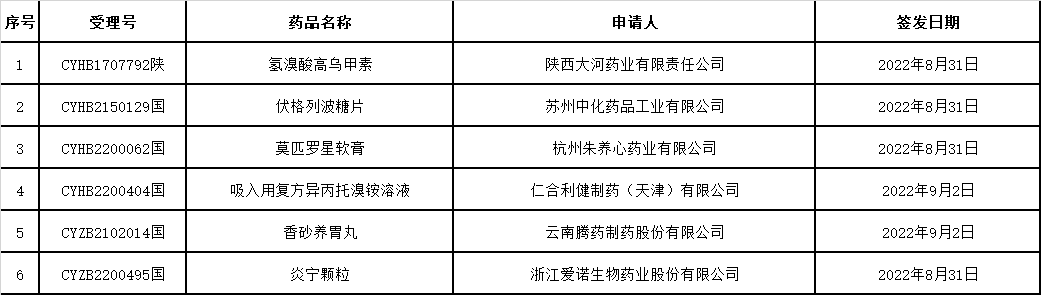
△2022年9月9日
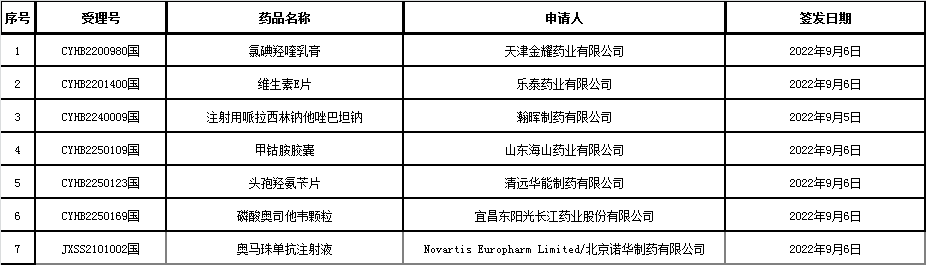
▲6、药品批准证明文件(纠错)待领取信息:本周无。
▲7、中药品种保护信息公示:淫羊藿总黄酮胶囊(首家中药二级保护)、舒肝解郁胶囊(首家中药二级保护),保护期限自2022年9月5日起七年。

▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、关于公开征求《阿片类口服固体仿制药防滥用药学研究技术指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/6b843bb75a9a764f31e7bf1a94d005fa

◆2、关于公开征求《复方药物临床试验技术指导原则(征求意见稿)》意见的通知
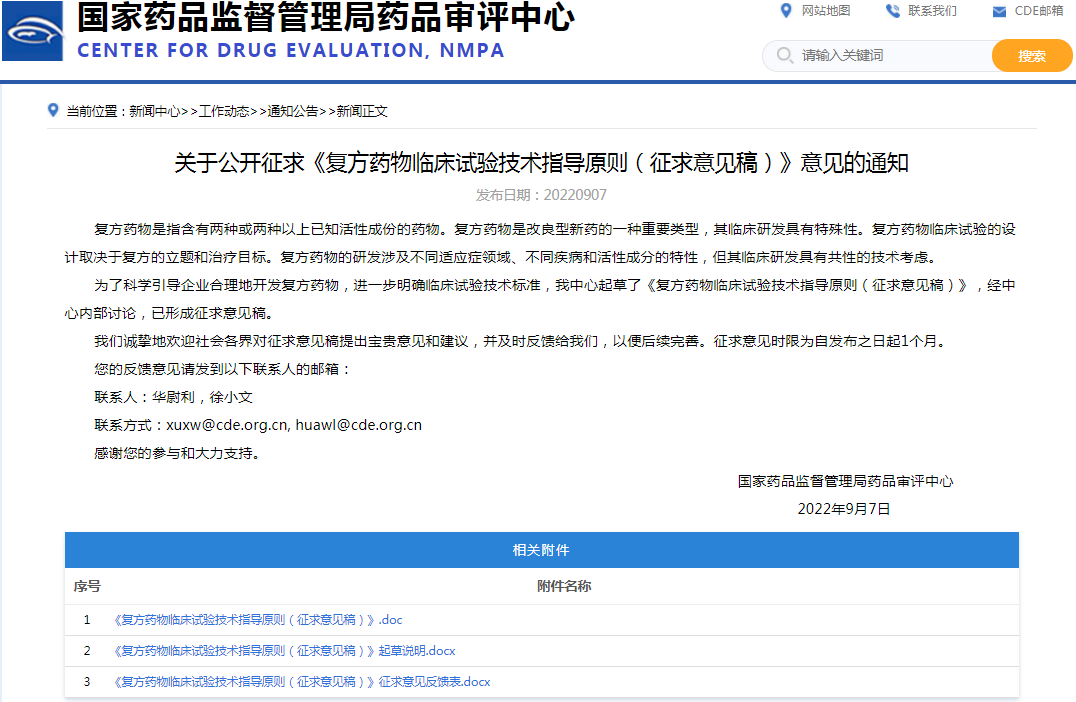
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/f26683428e27d2fc2572718ecfcc1490

◆3、关于公开征求ICH《Q3D(R2):元素杂质指导原则》实施建议和中文版的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/d4942097ca4b8868971a5c24bb0b5ae8

◆4、关于公开征求《化药口服固体制剂连续制造技术指导原则(征求意见稿)》意见的通知
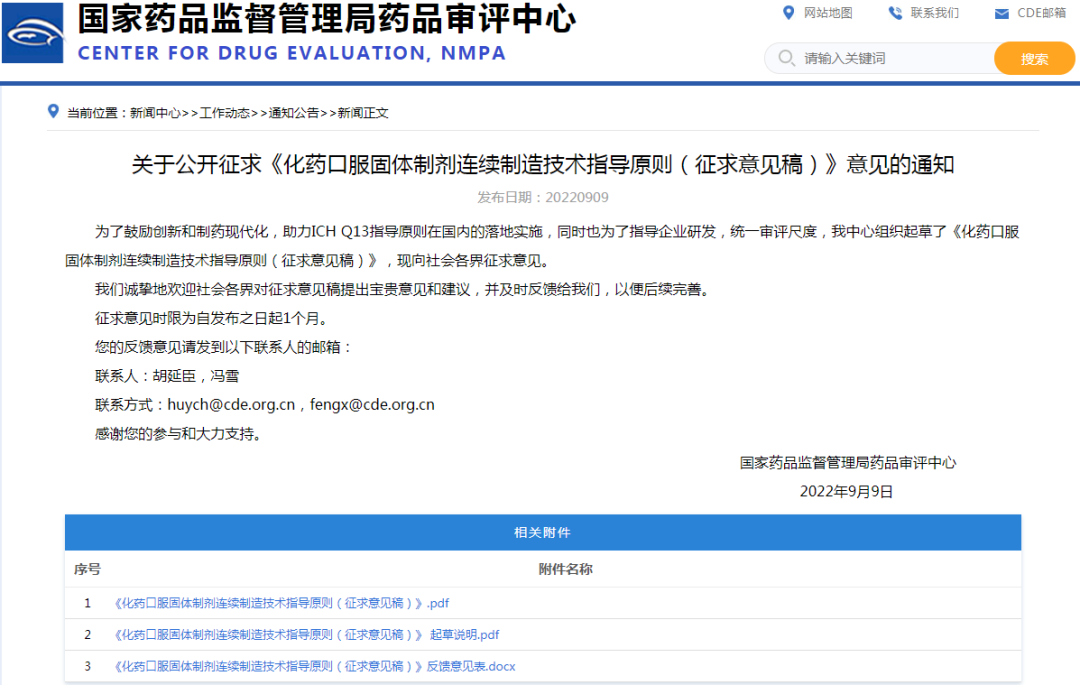
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/7d8c146eddae13375bcce130a2ba5307

☆四、CDE新承办信息公示类
■1、境内企业新药申报承办情况统计

■2、进口申报承办情况统计:

■3、境内企业仿制药申报承办情况统计:

■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
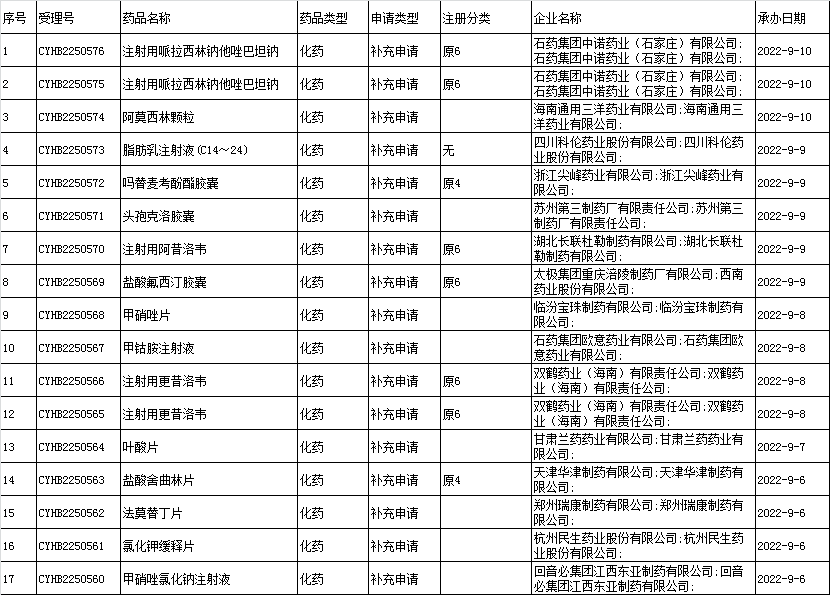
□(4)进口改变处方工艺的一致性评价:本周无。
■5、原料药登记信息公示:

■6、药用辅料登记信息公示:

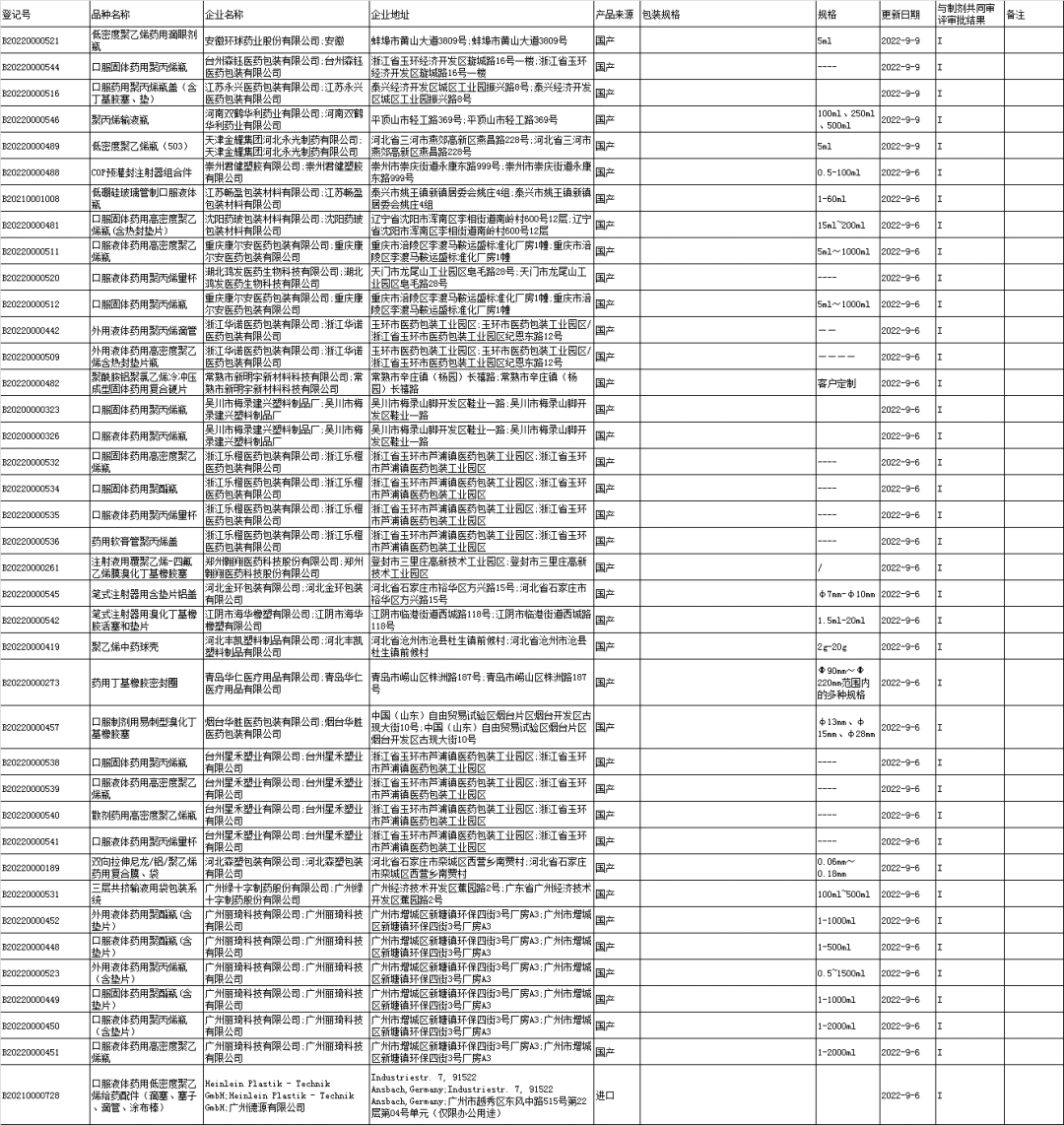
■7、药包材登记信息公示:
☆五、CDE信息公示类
●1、临床试验默示许可:新增86条,共计8075条

●2、优先审评公示
○(1)拟优先审评品种公示:本周无。
○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
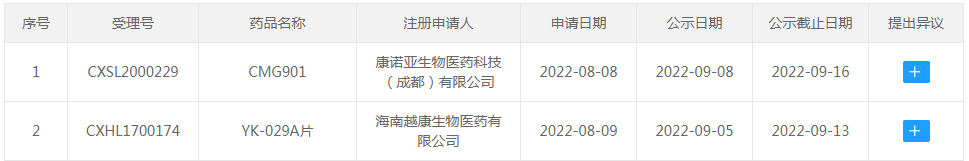
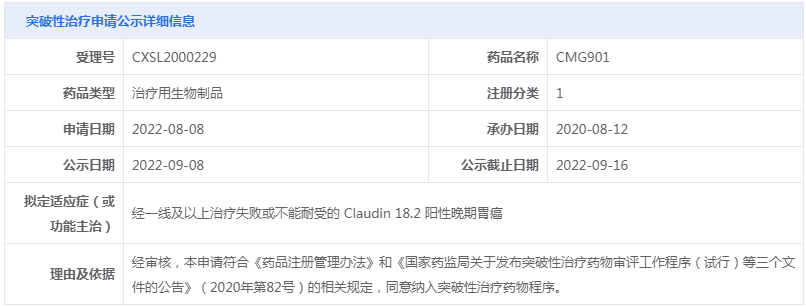
○(1)拟突破性治疗品种公示:CMG901、YK-029A片

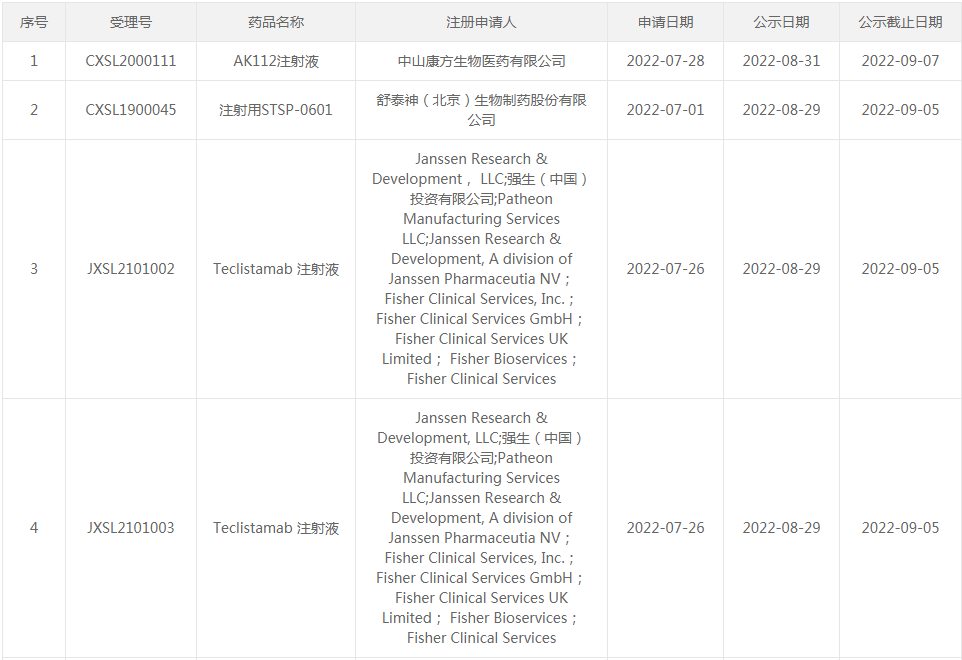
○(2)纳入突破性治疗品种:AK112注射液、注射用STSP-0601、Teclistamab 注射液


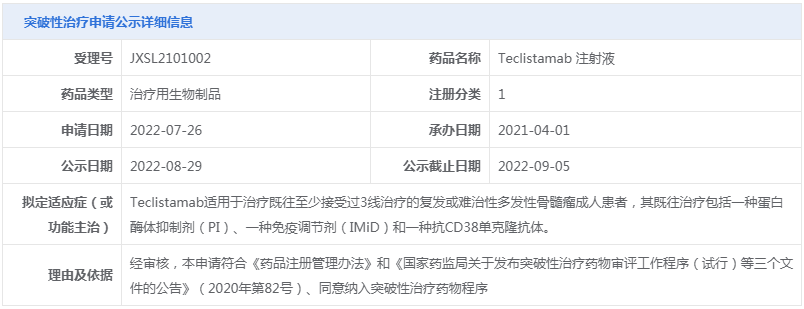

○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周无新增,第六十二批公示期限:2022年8月30日~2022年9月13日(10个工作日),公示共计六十二批
●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
●8、上市药品信息:新增7条,涉及5个品种为:替雷利珠单抗注射液、特瑞普利单抗注射液、阿立哌唑口溶膜、注射用紫杉醇聚合物胶束、重组甘精胰岛素注射液,信息公示共计959条
○(1)2022年09月06日:新增6条,涉及4个品种为:替雷利珠单抗注射液、特瑞普利单抗注射液、阿立哌唑口溶膜、注射用紫杉醇聚合物胶束
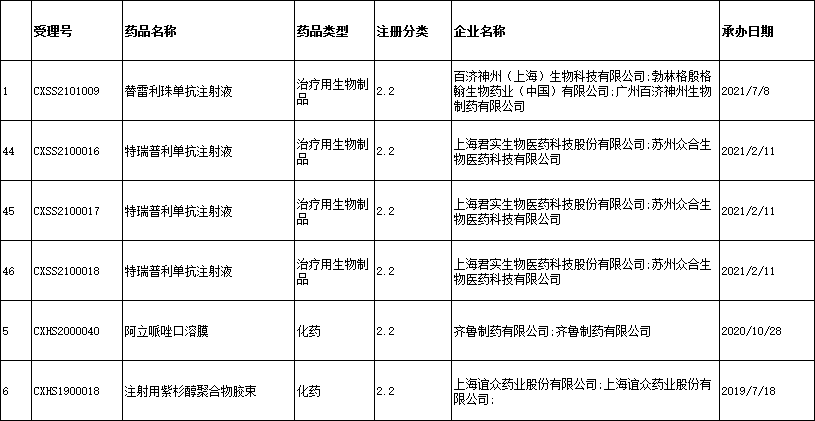
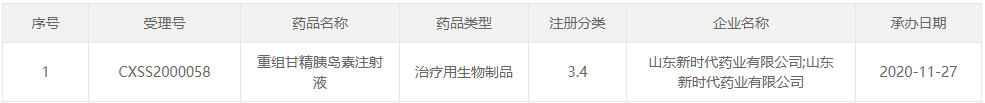
○(2)2022年09月08日:新增1条,涉及1个品种为:重组甘精胰岛素注射液
☆六、CMDE发布公示信息:
∮关于公开征求《液相色谱串联质谱系统注册审查指导原则》等2项医疗器械注册审查指导原则意见的通知
链接:
https://www.cmde.org.cn/xwdt/zxyw/20220906090452196.html

☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:
¢关于举办医疗器械生产企业质量体系实务培训班的通知

链接:
https://www.cfdi.org.cn/resource/news/14800.html

¢关于举办2022年第二期药物临床试验注册核查交流会的通知

链接:
https://www.cfdi.org.cn/resource/news/14802.html

☆九、CHP发布公示信息:
⊙关于鼓励参与塑料类药包材标准调研的通知

链接:
https://www.chp.org.cn/gjyjw/tz/17233.jhtml

⊙关于勘误百合(卷丹)配方颗粒国家药品标准有关内容的函
链接:
https://www.chp.org.cn/gjyjw/bzkwzy/17262.jhtml

⊙关于勘误蜜百合(卷丹)配方颗粒国家药品标准有关内容的函
链接:
https://www.chp.org.cn/gjyjw/bzkwzy/17238.jhtml

⊙标准公示——中药配方颗粒国家标准申报资料受理及审评情况的公示(第六期)、胰酶肠溶胶囊、胰酶肠溶片、格列美脲、泼尼松、赖氨酸磷酸氢钙颗粒、厄贝沙坦、盐酸氮芥、盐酸多沙普仑、盐酸赛洛唑啉、托吡卡胺、盐酸环丙沙星、盐酸特比萘芬国家药品标准草案的公示

☆十、NIFDC发布公示信息:本周无。
☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:
§国家市场监督管理总局食品审评中心关于举办2022 年度第二次婴幼儿配方乳粉产品配方注册宣贯会的通知

链接:
http://www.cfe-samr.org.cn/tzgg/202209/t20220905_4502.html

☆十三、CNCSDR发布公示信息:
¤国家药监局委托课题系列报道 ▏2022年度研究会立项课题中期会

¤课题系列报道 ▏2021年度研究会立项课题结题会




END

往期推荐




