国家药监局及直属单位药品相关数据信息一周集锦(2022-08-01至2022-08-06)


目录
☆一、NMPA政策文件发布征求类:
★国家中医药管理局办公室 国家药品监督管理局综合和规划财务司关于公开征求《古代经典名方关键信息表(25首方剂)(征求意见稿)》意见的通知
☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△新医疗器械上市批准信息公示:肠息肉电子结肠内窥镜图像辅助检测软件、可吸收再生氧化纤维素止血颗粒、脑炎/脑膜炎多重病原体核酸联合检测试剂盒(封闭巢式多重PCR熔解曲线法)
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布五十六批。
▲3、说明书修订信息:本周无。
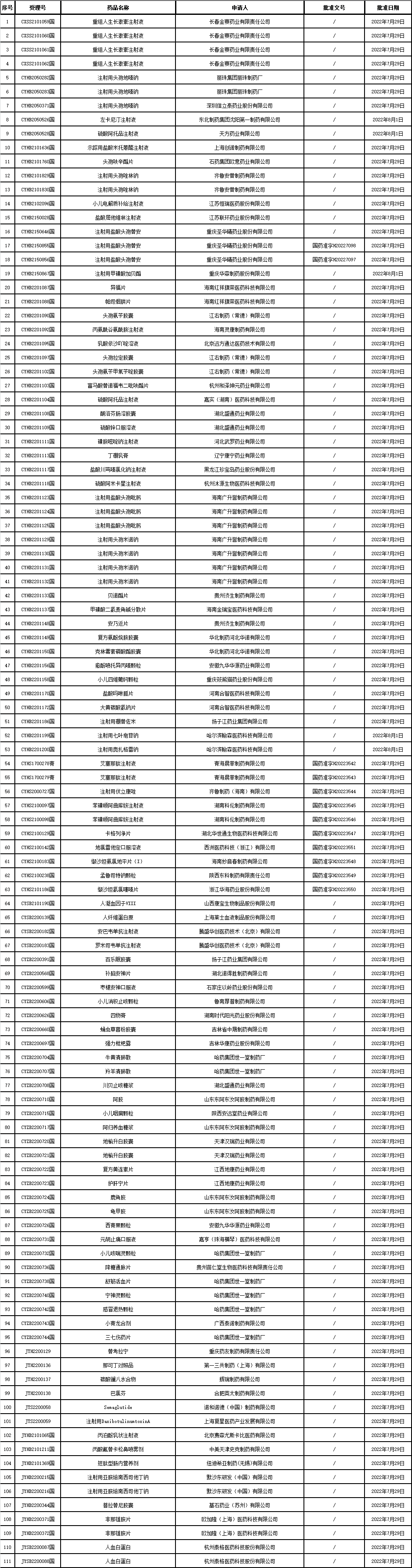
▲4、药品批准证明文件待领取信息发布:
△2022年8月4日
▲5、药品通知件待领取信息发布:
△2022年8月2日
△2022年8月3日
▲6、药品批准证明文件(纠错)待领取信息:
△2022年8月2日
△2022年8月4日
▲7、中药品种保护信息公示:本周无。
▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、发布《关于新型冠状病毒新流行株感染抗病毒新药非临床和临床评价标准的问与答》的通知
◆2、公开征求《原发性胆汁性胆管炎治疗药物临床试验技术指导原则》意见的通知
◆3、公开征求《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征求意见稿)》意见的通知
◆4、2022年度《国内外药品技术指导原则对比研究》课题开题会顺利召开
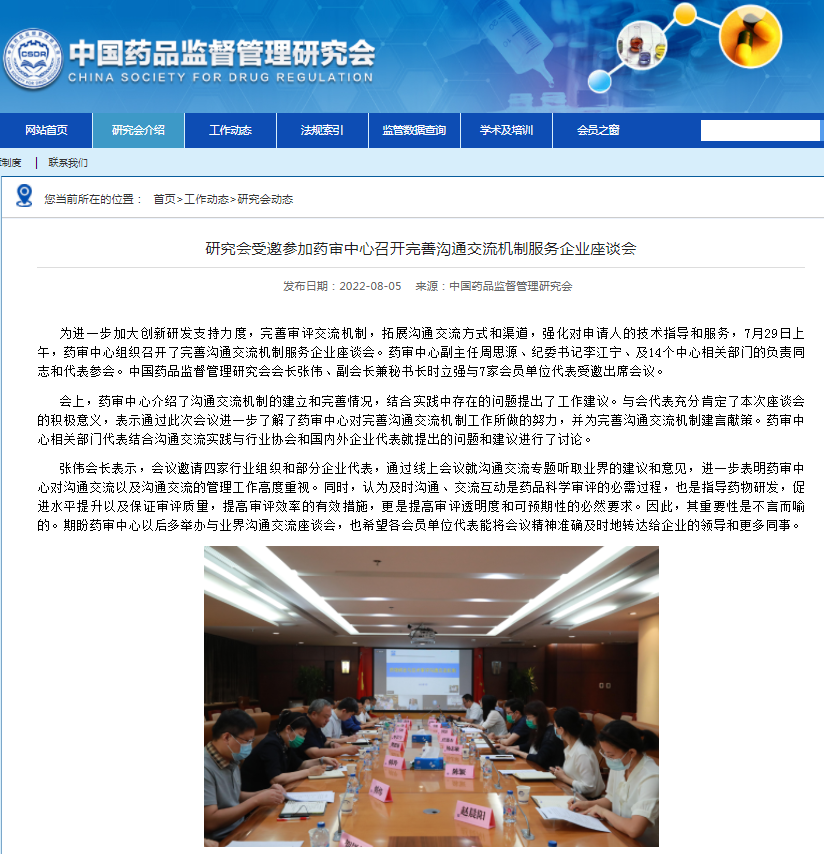
◆5、药审中心召开完善沟通交流机制服务企业座谈会
◆6、真实世界数据研究持续升温,10个药品纳入先行试点
☆四、CDE新承办信息公示类
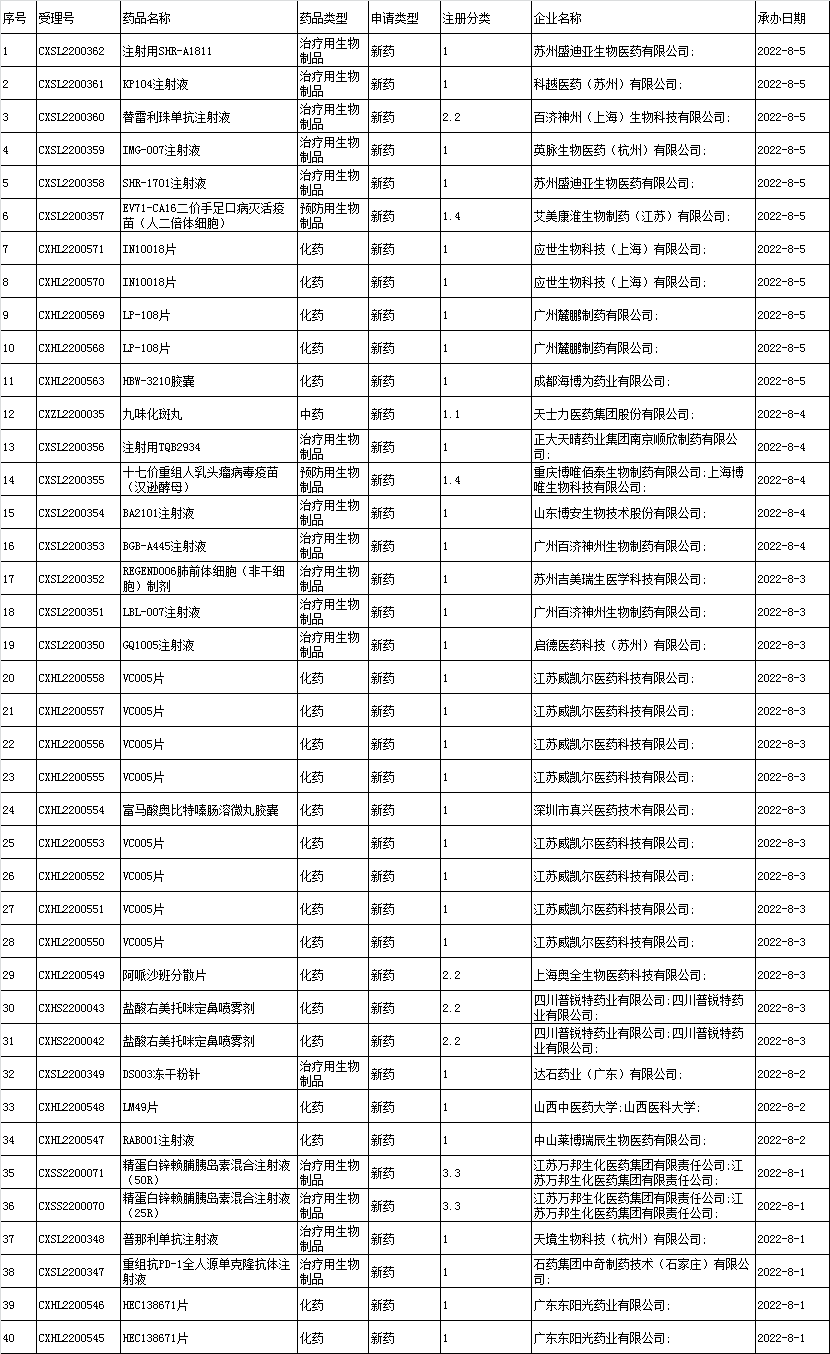
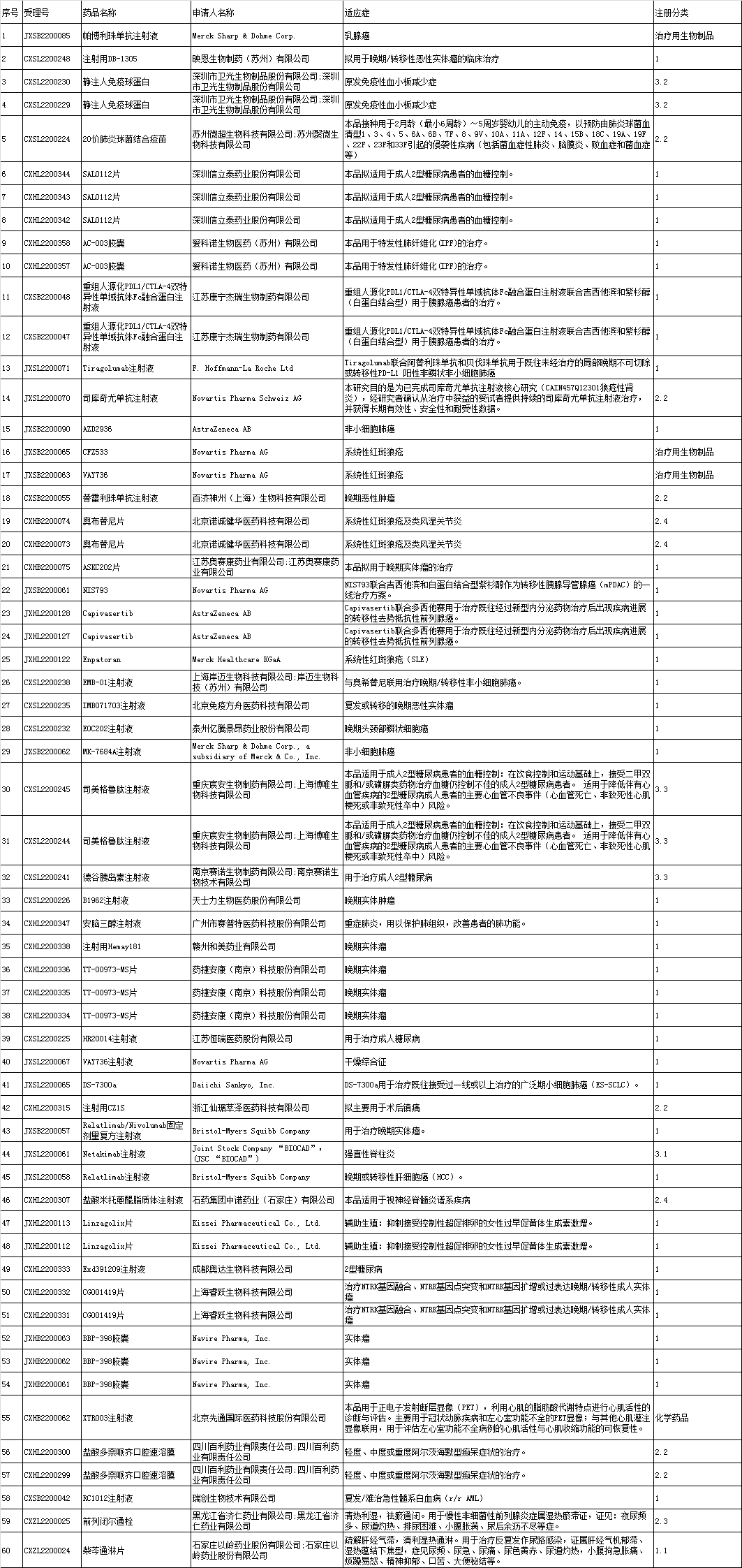
■1、境内企业新药申报承办情况统计
■2、进口申报承办情况统计:
■3、境内企业仿制药申报承办情况统计:
■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
□(4)进口改变处方工艺的一致性评价:
■5、原料药登记信息公示:
■6、药用辅料登记信息公示:
■7、药包材登记信息公示:
☆五、CDE信息公示类
●1、临床试验默示许可:新增60条,共计7755条
●2、优先审评公示
○(1)拟优先审评品种公示:本周无。
○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
○(1)拟突破性治疗品种公示:本周无。
○(2)纳入突破性治疗品种:本周无。
○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周无新增,第六十一批公示期限:2022年7月27日~2022年8月9日(10个工作日),公示共计六十一批。
●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
●8、上市药品信息:本周无新增,信息公示共计922条
☆六、CMDE发布公示信息:本周无。
☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:本周无。
☆九、CHP发布公示信息:
◎关于举办《中国药典》2025年版拟制修订药包材标准培训班的通知
◎关于第十二届药典委员会拟续聘及新增专业委员会委员名单的公示
◎国家药典委员会2022年度国家药品标准提高拟补充课题目录公示
◎关于鼓励参与金属类药包材标准调研的函
◎关于征集金属类药包材国家标准研究单位的通知
◎关于征求《中国药典》药用辅料标准与ICH Q3C协调方案意见的函
◎标准公示——征求《中国药典》滴点测定法标准草案意见、气体杂质测定法-气体检测管法标准草案意见、气体水分测定法-露点法标准草案意见
☆十、NIFDC发布公示信息:
∝中检院关于举办第十四期全国中药材鉴定与标本管理网络培训班的通知
☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:
∮关于规范申报工作的注意事项
☆十三、CNCSDR发布公示信息:
£药品流通监管研究专业委员会召开2022年第一次全体会议暨药品流通监管政策研讨会
£超限制造技术在制药领域的应用开题专家会暨云讲堂顺利召开
£研究会受邀参加药审中心召开完善沟通交流机制服务企业座谈会

☆一、NMPA政策文件发布征求类:
★国家中医药管理局办公室 国家药品监督管理局综合和规划财务司关于公开征求《古代经典名方关键信息表(25首方剂)(征求意见稿)》意见的通知


链接:
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220801171436142.html

☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△新医疗器械上市批准信息公示:肠息肉电子结肠内窥镜图像辅助检测软件、可吸收再生氧化纤维素止血颗粒、脑炎/脑膜炎多重病原体核酸联合检测试剂盒(封闭巢式多重PCR熔解曲线法)


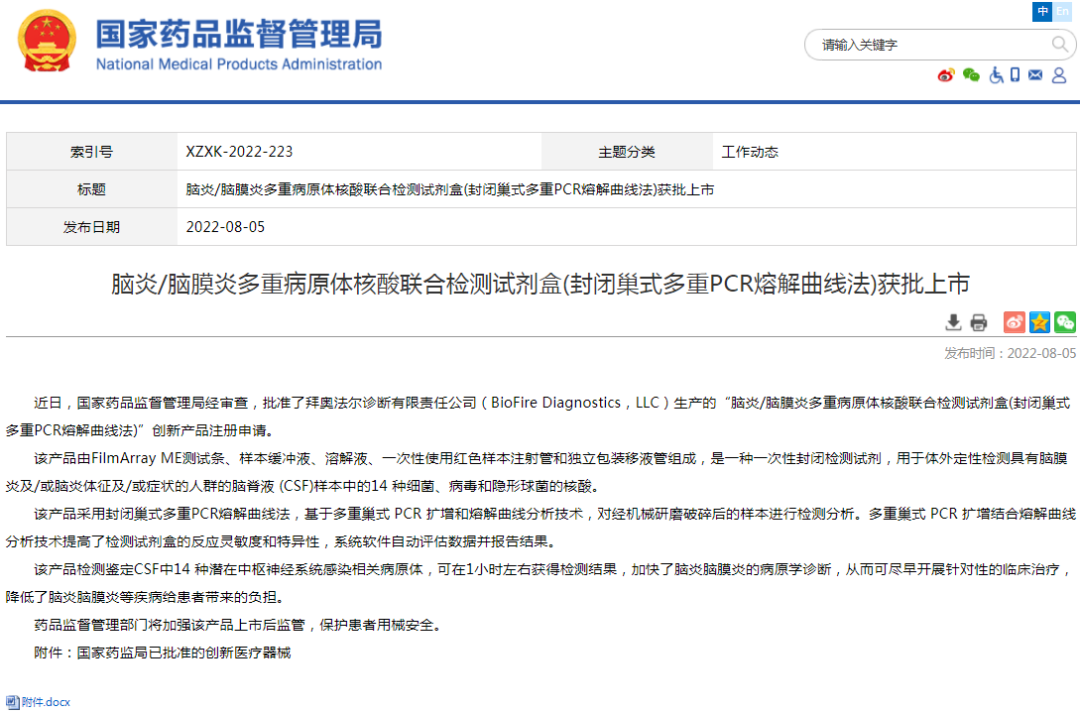
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布五十六批。
▲3、说明书修订信息:本周无。
▲4、药品批准证明文件待领取信息发布:
△2022年8月4日
▲5、药品通知件待领取信息发布:
△2022年8月2日

△2022年8月3日

▲6、药品批准证明文件(纠错)待领取信息:
△2022年8月2日
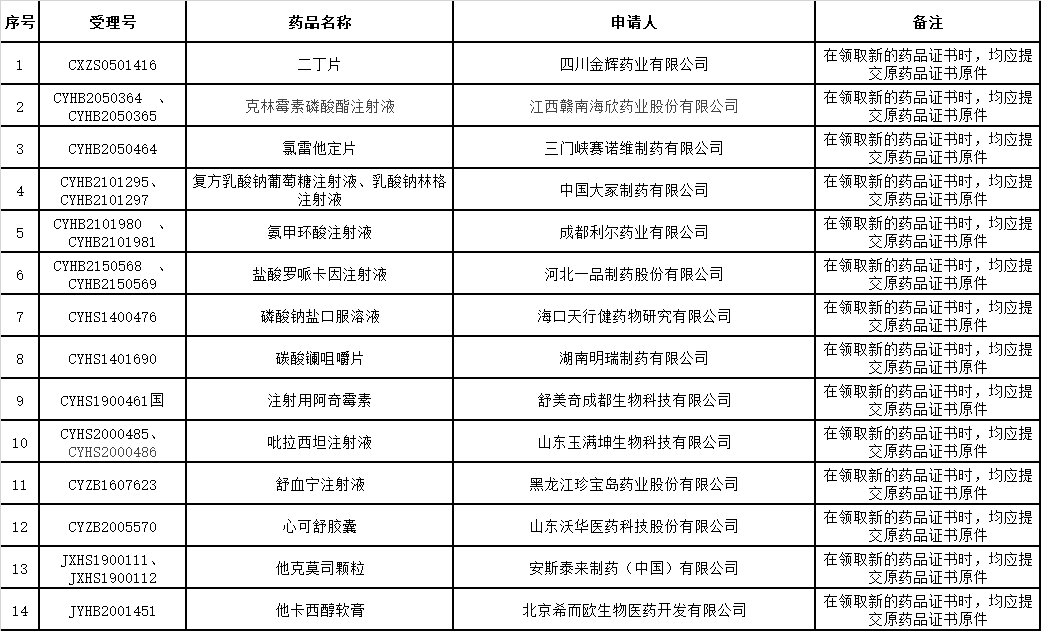
△2022年8月4日

▲7、中药品种保护信息公示:本周无。
▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、发布《关于新型冠状病毒新流行株感染抗病毒新药非临床和临床评价标准的问与答》的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/ac6ddac7a3072263de33960ff2b54236

◆2、公开征求《原发性胆汁性胆管炎治疗药物临床试验技术指导原则》意见的通知
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/82ded7ec4c53e6804234eceb1241a85e

◆3、公开征求《化学药品创新药Ⅲ期临床试验前会议药学共性问题及相关技术要求(征求意见稿)》意见的通知
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/49a0f10cde397b4bd86ad6fdfc2f2a2f

◆4、2022年度《国内外药品技术指导原则对比研究》课题开题会顺利召开
◆5、药审中心召开完善沟通交流机制服务企业座谈会

◆6、真实世界数据研究持续升温,10个药品纳入先行试点


☆四、CDE新承办信息公示类
■1、境内企业新药申报承办情况统计
■2、进口申报承办情况统计:

■3、境内企业仿制药申报承办情况统计:

■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
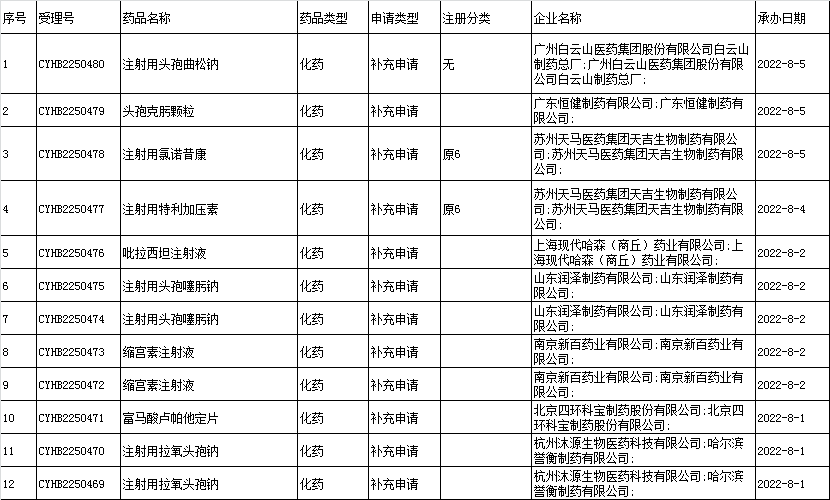
□(4)进口改变处方工艺的一致性评价:

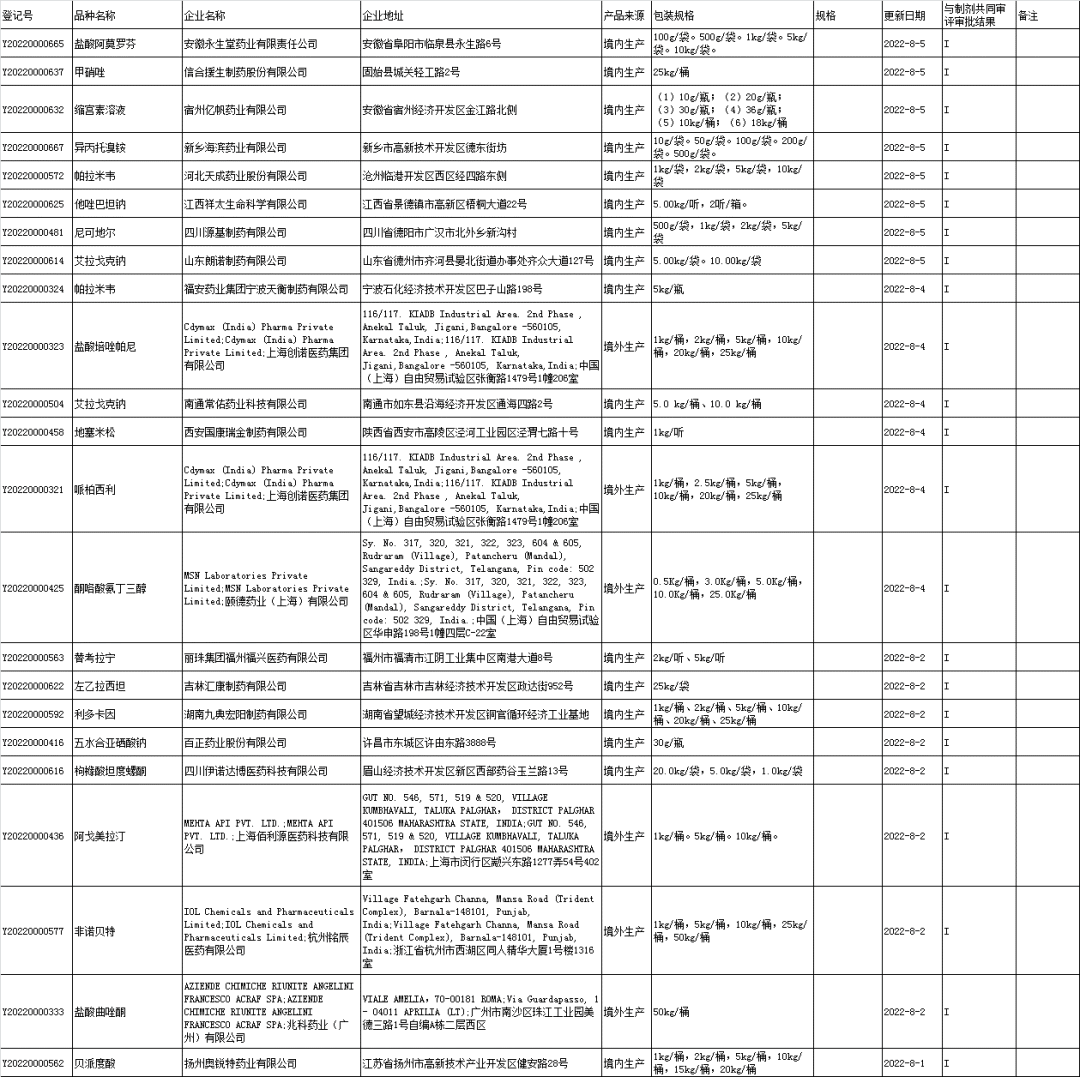
■5、原料药登记信息公示:
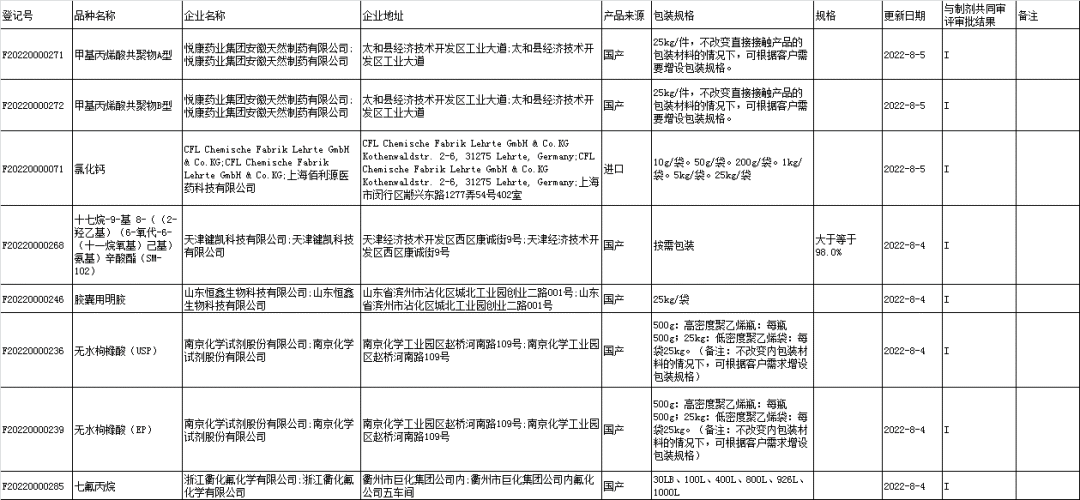
■6、药用辅料登记信息公示:
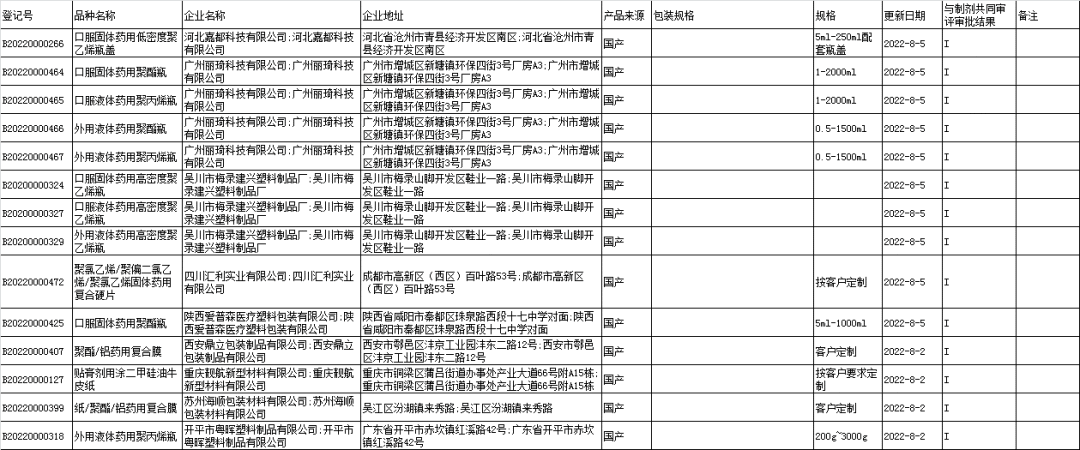
■7、药包材登记信息公示:
☆五、CDE信息公示类
●1、临床试验默示许可:新增60条,共计7755条
●2、优先审评公示
○(1)拟优先审评品种公示:本周无。
○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
○(1)拟突破性治疗品种公示:本周无。
○(2)纳入突破性治疗品种:本周无。
○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周无新增,第六十一批公示期限:2022年7月27日~2022年8月9日(10个工作日),公示共计六十一批。
●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
●8、上市药品信息:本周无新增,信息公示共计922条
☆六、CMDE发布公示信息:本周无。
☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:本周无。
☆九、CHP发布公示信息:
◎关于举办《中国药典》2025年版拟制修订药包材标准培训班的通知


链接:
https://www.chp.org.cn/gjyjw/tz/17186.jhtml

◎关于第十二届药典委员会拟续聘及新增专业委员会委员名单的公示

链接:
https://www.chp.org.cn/gjyjw/tz/17186.jhtml

◎国家药典委员会2022年度国家药品标准提高拟补充课题目录公示


链接:
https://www.chp.org.cn/gjyjw/tz/17186.jhtml

◎关于鼓励参与金属类药包材标准调研的函
链接:
https://www.chp.org.cn/gjyjw/tz/17187.jhtml

◎关于征集金属类药包材国家标准研究单位的通知

链接:
https://www.chp.org.cn/gjyjw/tz/17180.jhtml

◎关于征求《中国药典》药用辅料标准与ICH Q3C协调方案意见的函

链接:
https://www.chp.org.cn/gjyjw/tz/17183.jhtml

◎标准公示——征求《中国药典》滴点测定法标准草案意见、气体杂质测定法-气体检测管法标准草案意见、气体水分测定法-露点法标准草案意见
☆十、NIFDC发布公示信息:
∝中检院关于举办第十四期全国中药材鉴定与标本管理网络培训班的通知
链接:
https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/pxtzh/20220801091920208584.html

☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:
∮关于规范申报工作的注意事项

链接:
http://www.cfe-samr.org.cn/tzgg/202208/t20220804_4468.html

☆十三、CNCSDR发布公示信息:
£药品流通监管研究专业委员会召开2022年第一次全体会议暨药品流通监管政策研讨会

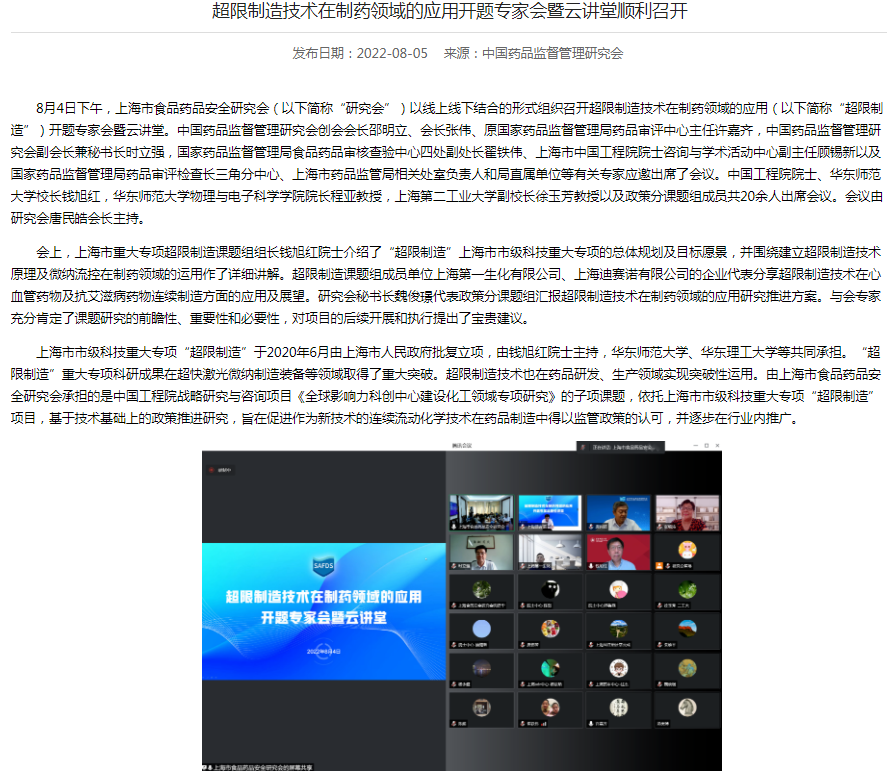
£超限制造技术在制药领域的应用开题专家会暨云讲堂顺利召开
£研究会受邀参加药审中心召开完善沟通交流机制服务企业座谈会

精彩专题
“凝聚红色力量,践行初心使命”阳光诺庆祝建党101华诞主题活动
《药视情报站》05期-对抗“儿童杀手—ALL“,微片技术显神功





