独家 · 中国孤儿药研发状况分析
2014年,风靡全球的“冰桶挑战”让大家认识了“渐冻症”,进而让罕见病这个概念进入大众视野。目前,全球公认的罕见病大约有7000余种,仅5%左右的疾病能被有效防治与治疗。由于我国尚无罕见病种类的统计数据和病种目录。因此,相当长时间内,罕见病及其治疗药物在中国的发展是缓慢而沉寂的。那么,国外已上市孤儿药在中国的研发注册进展究竟如何?有哪些疾病已有相关治疗药物?本文对此做一简单梳理。
由于中国当前并无明确的孤儿药定义,因此,本文所涉及孤儿药均指已获得欧盟、美国、日本三地之一认可,以孤儿药适应症获批上市,当前仍在市销售的药品(剔除退市、长期未注册药品,以及非孤儿药适应症上市的产品,如:aprotinin,其1993年获批孤儿药上市,但目前在美国已退市,将不在统计范围内),本研究统计时间截止到2017年10月20日。
一、欧美日孤儿药在中国研发注册进展分析
根据EMA、FDA及PMDA的官方数据,欧盟、美国、日本已批准上市且仍处于在市状态的孤儿药分别为98项、592项和253项(按适应症计)。由于欧盟的孤儿药资格授出后最长持续15年,本文统计的是当前仍具有孤儿药资格的药物。
从品种来看,欧、美、日三地共上市621个孤儿药品种(不同国家同一通用名药品,以及同一国家同一通用名/活性成分按同一个品种计算)。按同通用名药在中国的最高注册进展来看,这621个孤儿药在中国的最高研发进展如下图所示:
欧美日已上市孤儿药在中国最高注册研发进展
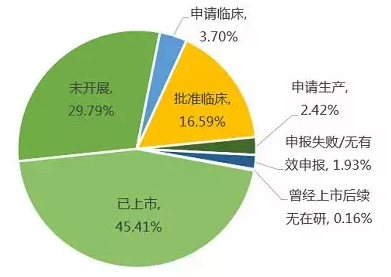
值得欣慰的是,欧美日已上市的621个品种中,按通用名/活性成分来看,有45.41%(282个)已在中国上市;有22.71%(141个)在中国处于研发阶段,表明虽然中国官方形式的孤儿药政策并未公布,企业已提早在市场开展相关布局。然而,令人惋惜的是,目前仍有29.79%的孤儿药尚未引入国内。如:治疗II型粘多糖沉积病/亨特氏综合症的Elaprase,其在欧美日均已上市,而在中国尚未引入。不过,随着药品审评审批制度的改革,相信国外已上市孤儿药会加快进入中国市场。
以下,具体来看欧美日已上市孤儿药在中国的最高注册进展:
1. 欧盟
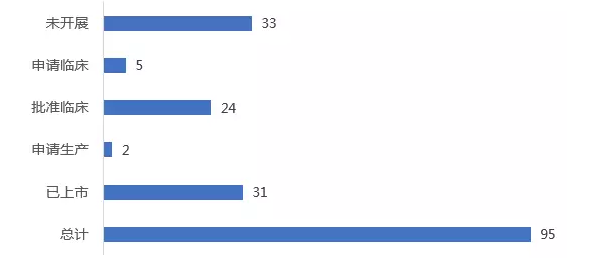
欧盟已获批上市孤儿药中,有31个在中国已上市,31个处于研发阶段,33个仍未引入中国,如:治疗于治疗红细胞生成性原卟啉症的Scenesse,其于2014年获得孤儿药资格授权(活性成分于2008年被授予孤儿药资格),在中国研发注册进展稍显滞后。
欧盟已上市孤儿药在中国最高注册进展
2. 日本
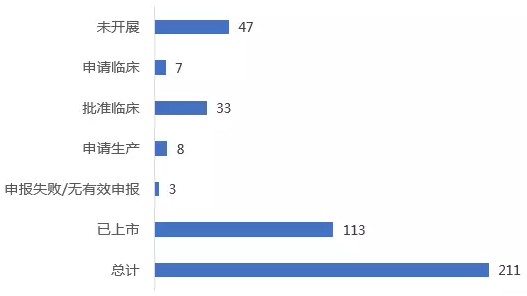
日本已获批上市孤儿药中,有一半已在中国上市,如协和发酵麒麟的治疗甲状旁腺癌患者高钙血症的Regpara(盐酸西卡那塞);也有较多药品已在中国开展研发,如:治疗非小细胞肺癌的Alecensa(盐酸艾乐替尼),治疗系统性间变性大细胞淋巴瘤的Adcetris等。可能是由于疾病谱较为接近且二者同为亚洲重要的医药市场的原因,两国产品研发上市较为同步。不过,遗憾的是,日本仍有较多产品尚未在中国开展注册申报,如:用于治疗粘多糖增多症Ⅵ的Naglazyme,其2008年已在日本以孤儿药身份上市,但目前仍未进入中国市场。
日本已上市孤儿药在中国最高注册进展
3. 美国
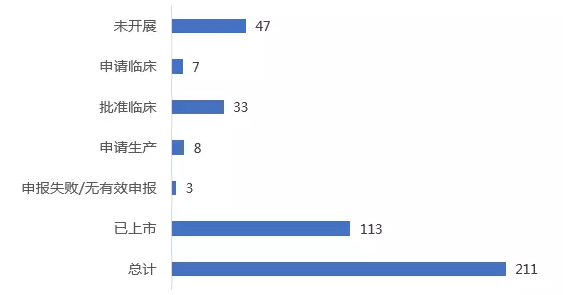
美国已上市孤儿药中,有184个已在中国上市(剔除已退市药物及非孤儿药适应症上市药物),但仍有60%的药物未在中国上市,包括:2017年FDA新批上市的首个用于神经胶质瘤荧光光学显像剂的Gleolan,2017年FDA批准的用于治疗II型晚期婴儿型神经元蜡样脂褐质沉积症的Brineura等。
过去,由于中国药品审评审批时间较长,且对境外临床试验数据不认可,造成国外创新药在中国上市的缓慢。但是,随着国家一系列临床试验管理及加快审评审批的政策,以及孤儿药相关政策体系的完善,相信未来将会有更多孤儿药进入中国市场。
美国已上市孤儿药在中国最高注册进展
二、中国已上市孤儿药疾病覆盖情况
上文提及,欧美日已上市的621个品种中,按通用名/活性成分来看,有45.41%(282个)已在中国上市,那么,这些已上市品种中,到底覆盖哪些疾病呢?本文根据该孤儿药获批上市时对应的适应症,进行汇总分析,整理后共涉及249种疾病,肿瘤领域疾病有64种,占比达25.7%,为上市药品覆盖最多的疾病领域。
另外,虽然中国尚无国家层面对于罕见病的定义,但是,一些NGO机构与地方政府,已经根据实际情况,陆续出台罕见病目录。2016年2月,上海市卫生和计划生育委员会根据本市实际情况,制定了包含56种疾病的罕见病目录,明确各疾病的诊断方法和主要治疗原则,在罕见病诊疗上走在全国前列。同年9月,我国罕见病发展中心(CORD)特别发布了《中国罕见病参考名录》,共有147项病种,包括血友病、多发性骨髓瘤、戈谢病等相对较为常见的罕见病。此外,网上还有一份广东省出台的罕见病目录,共有49种疾病。对这三版罕见病目录进行对比,可以发现,诸如法布雷病、血友病、肺动脉高压等疾病,均出现在三版目录中,说明各地对于一些罕见病保障的认知基本相同。笔者通过整理发现,三版目录总计覆盖164种疾病。
以下,笔者将对欧美日获批上市的孤儿药适应症与这164种疾病进行对比分析。整理后发现,这164种疾病中,有49种疾病国外已有相应治疗药物上市,见下表。
民间版罕见病相关药物中国开发进展
(统计截至2017/10/20)
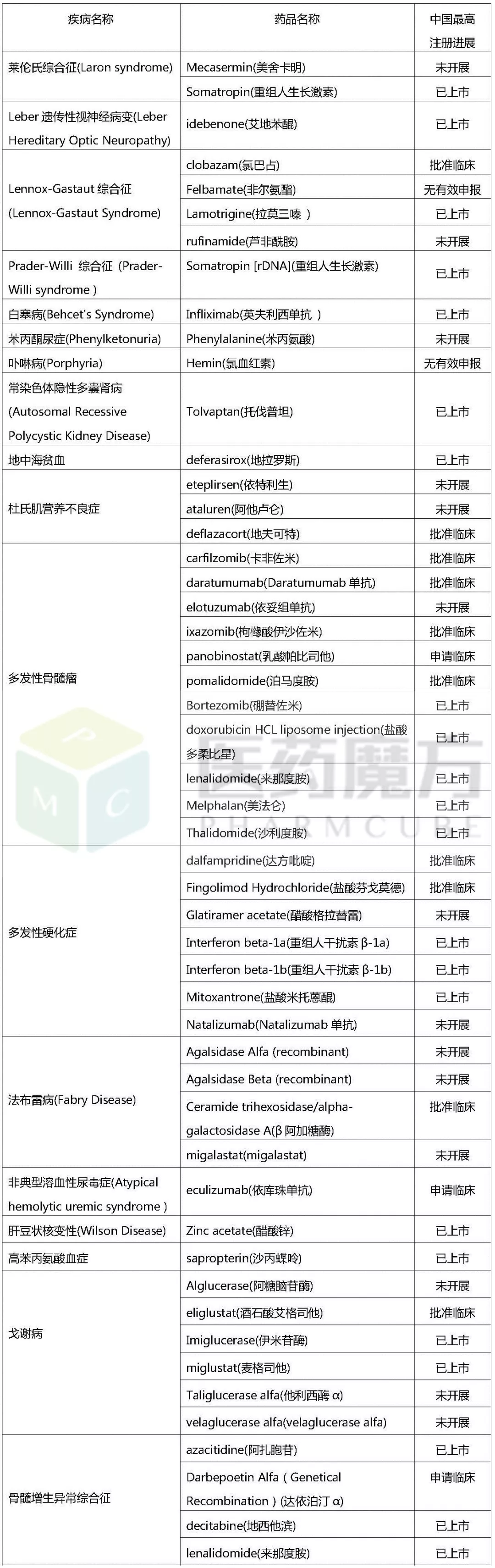
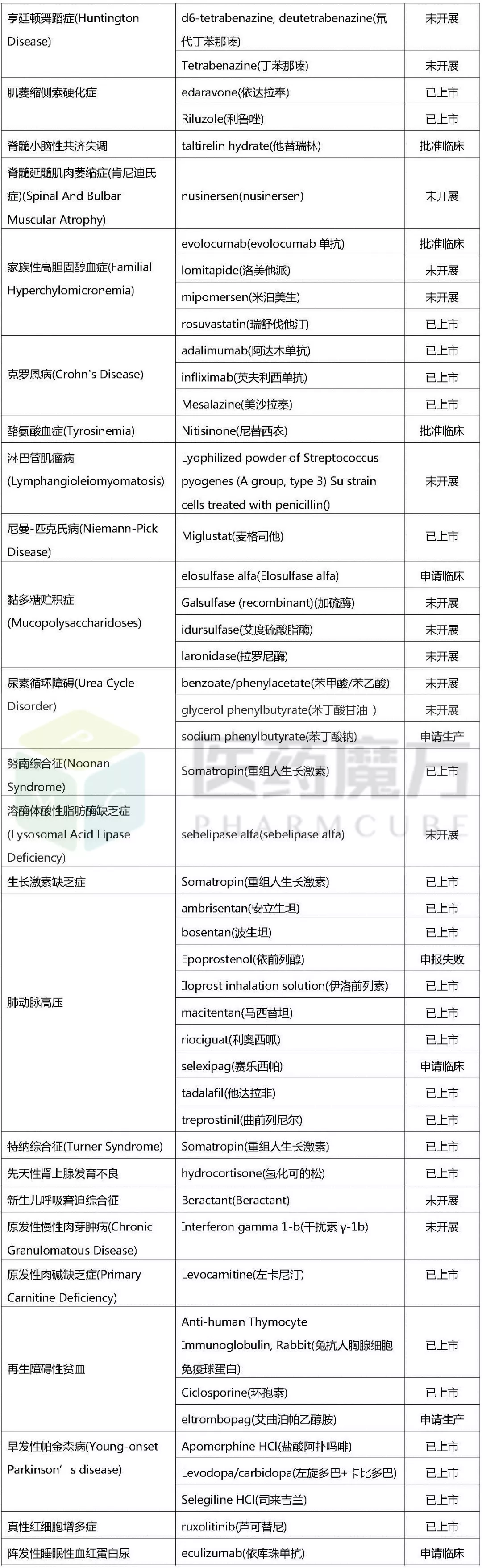
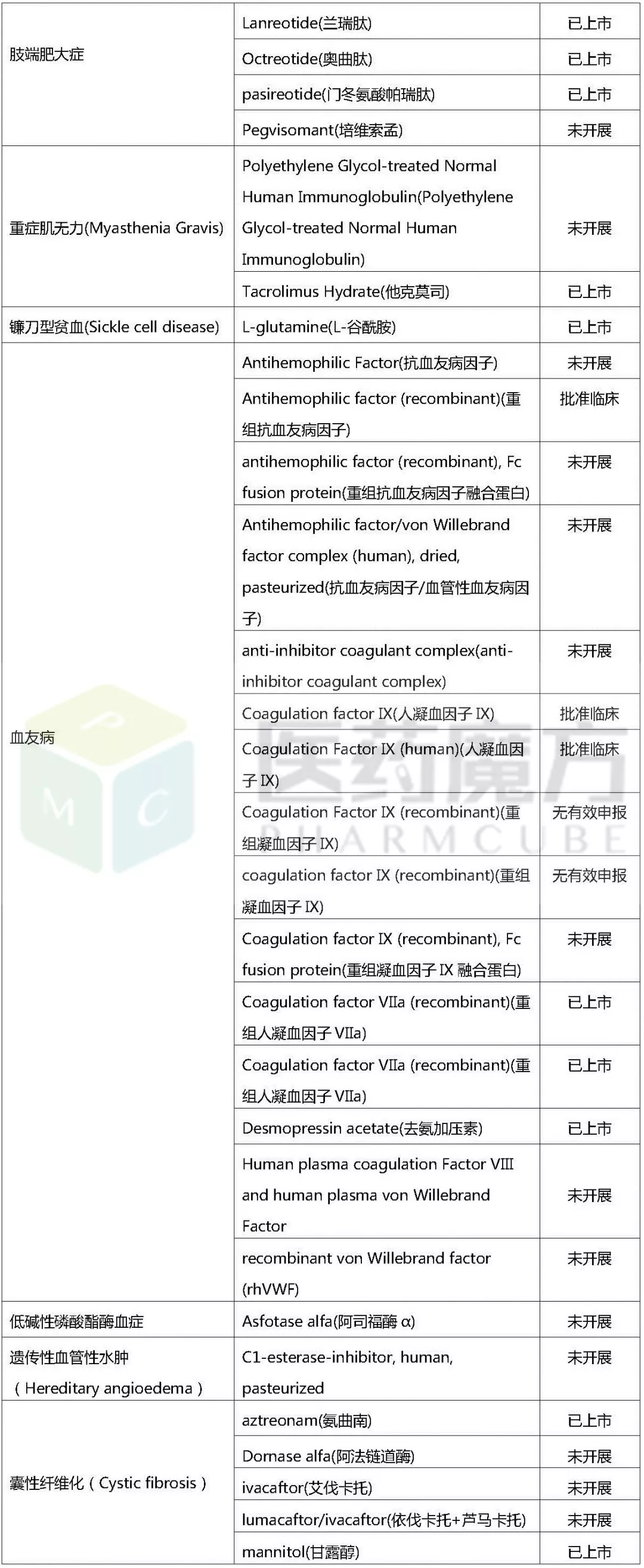
通过上表的数据,对上述49种罕见病可作如下简单分析:
国内外研发同步,国内已有多个品种上市,如:克罗恩病、早发性帕金森病等,其在国内外研发均相对较为成熟;
国内研发进展紧追国外,国内已有多个在研品种,如:多发性骨髓瘤,部分治疗药品已在中国上市,部分仍处于研发中;
国内研发进展远落后于国外,国外相关品种在国内均未开展研发,如:法布雷病和黏多糖贮积症,国外已上市三个药品在国内均未引入。
整体而言,中国罕见病治疗药品研发已引起相关企业重视,国家政策对罕见病用药的扶持逐步强化,CDE对于孤儿药的优先审评审批,让企业发现孤儿药研发的重大机遇。同时,2017年10月8日,中共中央办公厅国务院办公厅关于《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,再一次明确提出支持罕见病治疗药品医疗器械研发,包括:公布罕见病目录、减免临床及药品附带条件上市等政策,为罕见病患者带来巨大福音。政策已在弦上,亟待细则落地,孤儿药在中国即将进入发展黄金期。相信随着中国孤儿药政策的逐步完善,将会有更多企业加入孤儿药研发布局中,惠及更多罕见病患者。


