国家药监局及直属单位药品相关数据信息一周集锦(2023-01-01至2023-01-07)


目 录
一
NMPA政策文件发布征求类:
-
国家药监局关于印发进一步加强中药科学监管促进中药传承创新发展若干措施的通知
-
国家药监局综合司关于加强新冠防控药品拆零销售质量监管工作的通知
-
全国药品监督管理工作会议在京召开
二
NMPA信息公示类:
-
上市批准信息公示:
(1)新药上市批准信息公示:艾诺米替片
(2)新医疗器械上市批准信息公示:体外膜肺氧合治疗(ECMO)产品、病人监护仪
(3)其他上市信息公示:对乙酰氨基酚维生素C泡腾片等13个新冠病毒感染对症治疗药物上市、布洛芬片等5个新冠病毒感染对症治疗药物增产扩能补充申请
-
仿制药参比制剂目录发布信息:本周无新增,共计发布六十二批。
-
说明书修订信息:本周无。
-
药品批准证明文件送达信息发布:
(1)2023年1月3日
(2)2023年1月5日
-
药品通知件待领取信息发布:
(1)2023年1月3日
-
药品批准证明文件(纠错)待领取信息:本周无。
-
中药品种保护信息公示:银杏二萜内酯葡胺注射液(初保)、注射用血塞通(冻干)(续保)
-
药品注册证书注销、暂停进口信息:本周无。
-
补充检验方法信息:本周无。
三
CDE药品技术指导原则、指南发布类征求类:
-
国家药监局药审中心关于发布《药物临床试验盲法指导原则(试行)》的通告(2022年第49号)
-
关于更新PDF文件批量电子签章软件的通知
-
关于公开征求《2型糖尿病口服药物复方制剂研发指导原则(征求意见稿)》意见的通知
-
关于公开征求ICH《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》实施建议和中文版的通知
-
关于公开征求ICH《M11:临床电子结构化协调方案(CeSHarP)》指导原则草案意见的通知
-
关于公开征求《中药改良型新药研究技术指导原则(征求意见稿)》意见的通知
-
孔繁圃:多措并举提升药品审评效率和质量
四
CDE新承办信息公示类:
-
境内企业新药申报承办情况统计:
-
进口申报承办情况统计:
-
境内企业仿制药申报承办情况统计:
-
化药一致性评价申报承办情况统计:
(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:
(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
(3)国内改变处方工艺的一致性评价:
(4)进口改变处方工艺的一致性评价:本周无。
-
原料药登记信息公示:
-
药用辅料登记信息公示:
-
药包材登记信息公示:
五
CDE信息公示类:
-
临床试验默示许可:新增66条,共计9036条
-
优先审评公示
(1)拟优先审评品种公示:Glofitamab (RO7082859)、舒沃替尼片
(2)纳入优先审评品种:本周无。
(3)异议论证结果查询:本周无。
-
突破性治疗公示
(1)拟突破性治疗品种公示:本周无。
(2)纳入突破性治疗品种:GFH925片
(3)异议论证结果查询:本周无。
-
《化学仿制药参比制剂目录》的公示:本周无新增,第六十五批公示期限:2022年12月29日~2023年1月11日(10个工作日),公示共计六十五批
-
共性问题:
(1)受理共性问题:本周无新增,共计36条
(2)常见一般性技术问题:本周无新增,共计149条
-
仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
-
eCTD专栏 >> 常见问答:本周无新增,共计15条
-
上市药品信息:新增3条,涉及3个品种为:环泊酚注射液、妥布霉素吸入溶液、奥马珠单抗注射液,信息公示共计1024条
(1)2023年1月3日:新增3条,涉及3个品种为:环泊酚注射液、妥布霉素吸入溶液、奥马珠单抗注射液
六
CMDE发布公示信息:
-
创新医疗器械特别审查申请审查结果公示(2022年第9号)
-
关于公开征求《重组胶原蛋白创面敷料注册审查指导原则(征求意见稿)》意见的通知
七
NMPAIC发布公示信息:
-
国家药监局发布《化妆品生产许可管理基本数据集》等5个化妆品信息化标准
八
CFDI发布公示信息:
本周无。
九
CHP发布公示信息:
-
国家药典委员会关于公开征求2023年度药品标准培训需求的通知
-
标准公示——预灌封注射器2个通则标准草案的公示、药包材不溶性微粒测定法标准草案的公示、预灌封注射器9个通用检测方法标准草案的公示、痛经宝颗粒国家药品标准草案的公示、心速宁胶囊国家药品标准草案的公示、血塞通软胶囊国家药品标准草案的公示
十
NIFDC发布公示信息:
本周无。
十一
CDR-ADR发布公示信息:
本周无。
十二
CFE-SAMR发布公示信息:
本周无。
十三
CNCSDR发布公示信息:
-
课题系列报道 ▏2022年度研究会立项课题结题会:《儿童制剂用辅料安全性数据库的建立》、《数据保护相关政策研究及展望》、《中国化妆品标准体系研究》、《化妆品注册备案中原料安全相关信息报送调查研究》、《人工智能医疗器械全生命周期动态管理体系研究》、《医疗器械安全公众满意度方法构建与实践研究》、《临床试验安全性评价与风险预警的智能化药物警戒体系研究》、《基于风险管理的医疗器械科学监管体系模型》、《社会组织在化妆品安全治理中的作用研究》
-
国家药监局委托课题系列报道 ▏2022年度研究会立项课题结题会:新《药品管理法》背景下药品标准形成机制研究
一
NMPA政策文件发布征求类:
1、国家药监局关于印发进一步加强中药科学监管促进中药传承创新发展若干措施的通知




链接:
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20230103172324162.html

2、国家药监局综合司关于加强新冠防控药品拆零销售质量监管工作的通知

3、全国药品监督管理工作会议在京召开

二
NMPA信息公示类:
1、上市批准信息公示:
(1)新药上市批准信息公示:艾诺米替片

(2)新医疗器械上市批准信息公示:体外膜肺氧合治疗(ECMO)产品、病人监护仪
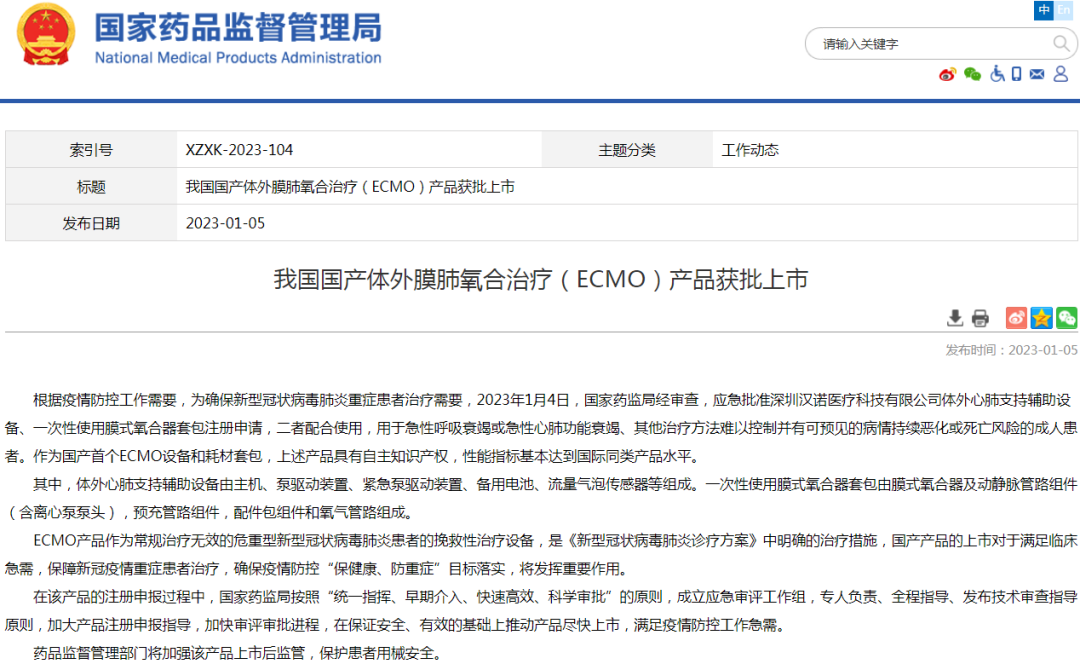
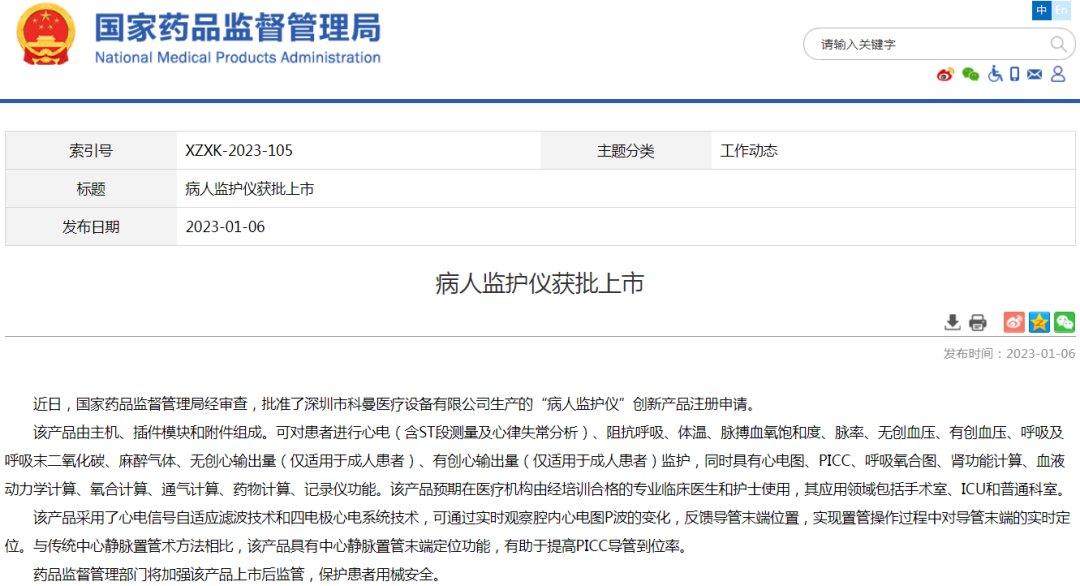
(3)其他上市信息公示:对乙酰氨基酚维生素C泡腾片等13个新冠病毒感染对症治疗药物上市、布洛芬片等5个新冠病毒感染对症治疗药物增产扩能补充申请

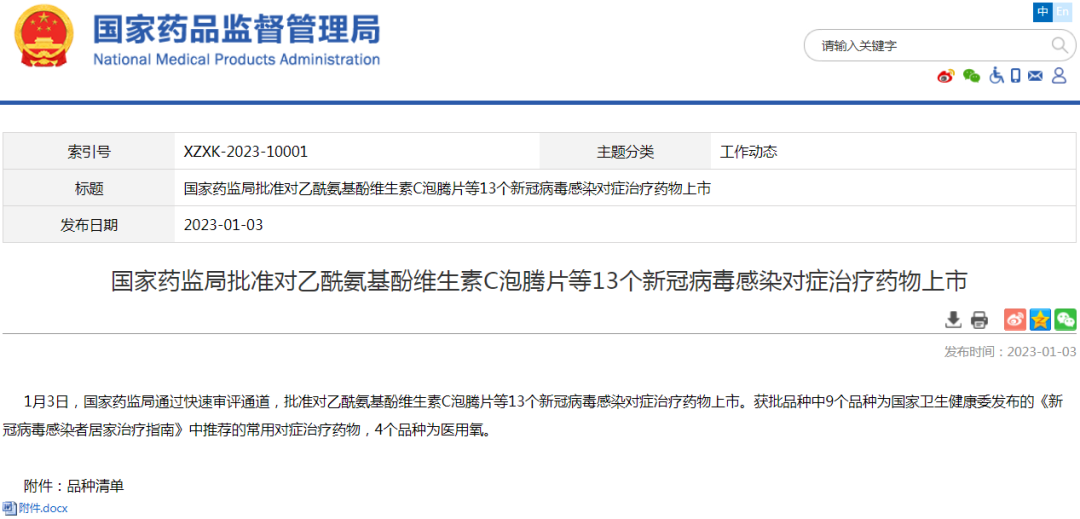


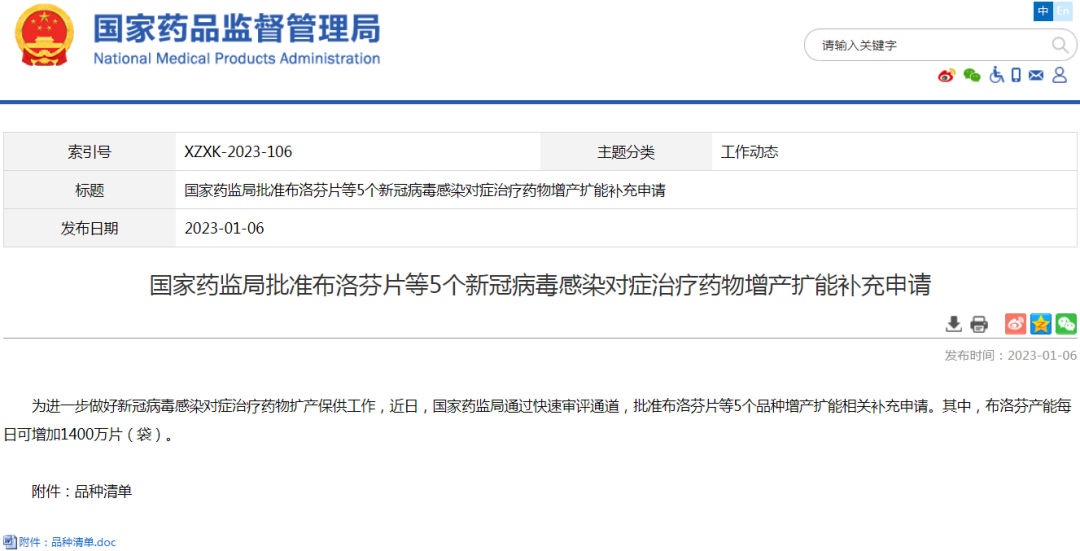
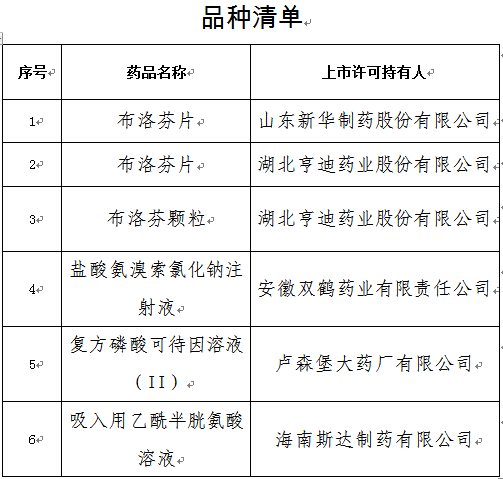
2、仿制药参比制剂目录发布信息:本周无新增,共计发布六十二批。
3、说明书修订信息:本周无。
4、药品批准证明文件送达信息发布:
(1)2023年1月3日
2022年11月1日起,行政相对人可登录网上办事大厅的法定代表人空间查看电子证照,按照法人空间内相关提示自行打印。

(2)2023年1月5日
2022年11月1日起,行政相对人可登录网上办事大厅的法定代表人空间查看电子证照,按照法人空间内相关提示自行打印。
5、药品通知件待领取信息发布:
(1)2023年1月3日
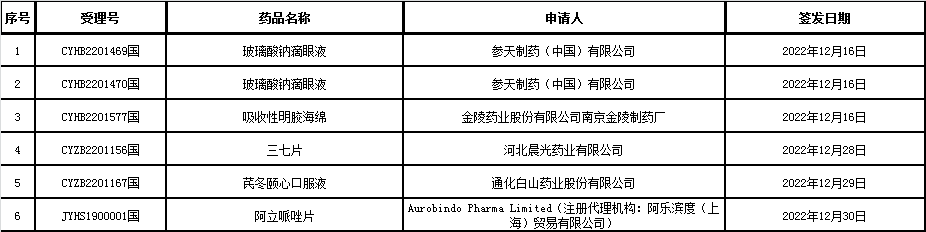
6、药品批准证明文件(纠错)待领取信息:本周无。
7、中药品种保护信息公示:银杏二萜内酯葡胺注射液(初保)、注射用血塞通(冻干)(续保)

8、药品注册证书注销、暂停进口信息:本周无。
9、补充检验方法信息:本周无。
三
CDE药品技术指导原则、指南发布类征求类:
1、国家药监局药审中心关于发布《药物临床试验盲法指导原则(试行)》的通告(2022年第49号)
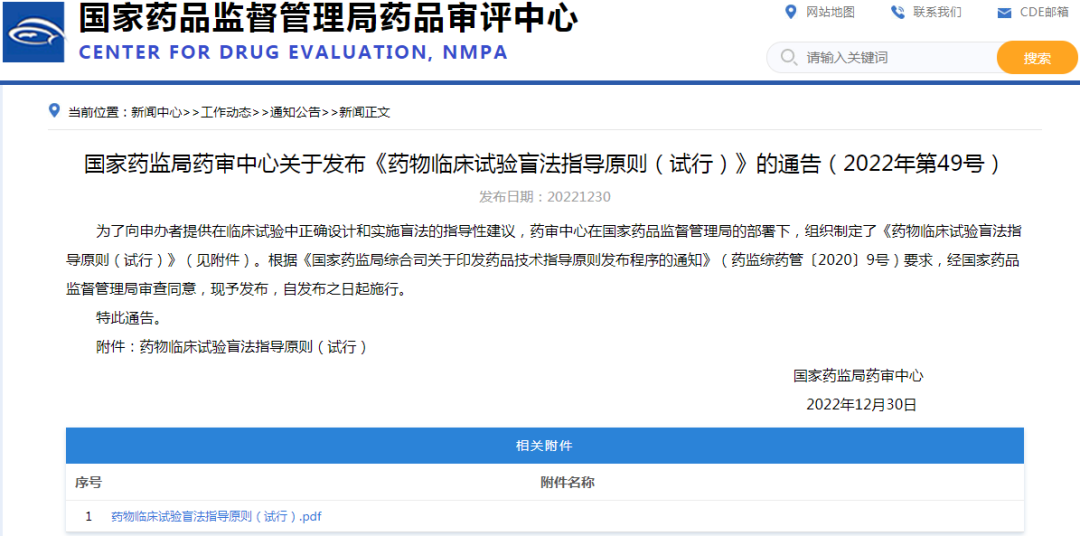
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/d32fdd9744fab914a3d8c360eac14e3c

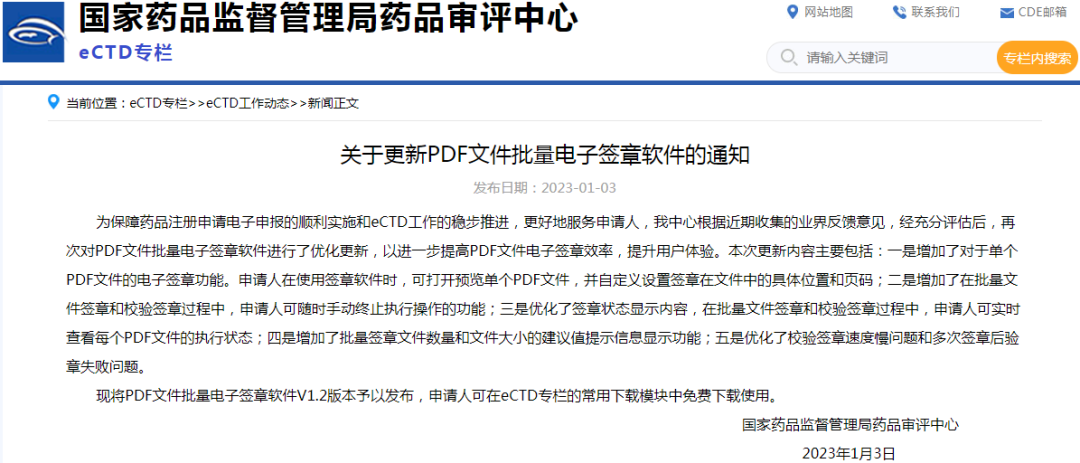
2、关于更新PDF文件批量电子签章软件的通知

3、关于公开征求《2型糖尿病口服药物复方制剂研发指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/c10853cbf36f639af66178600a6a94e9

4、关于公开征求ICH《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》实施建议和中文版的通知
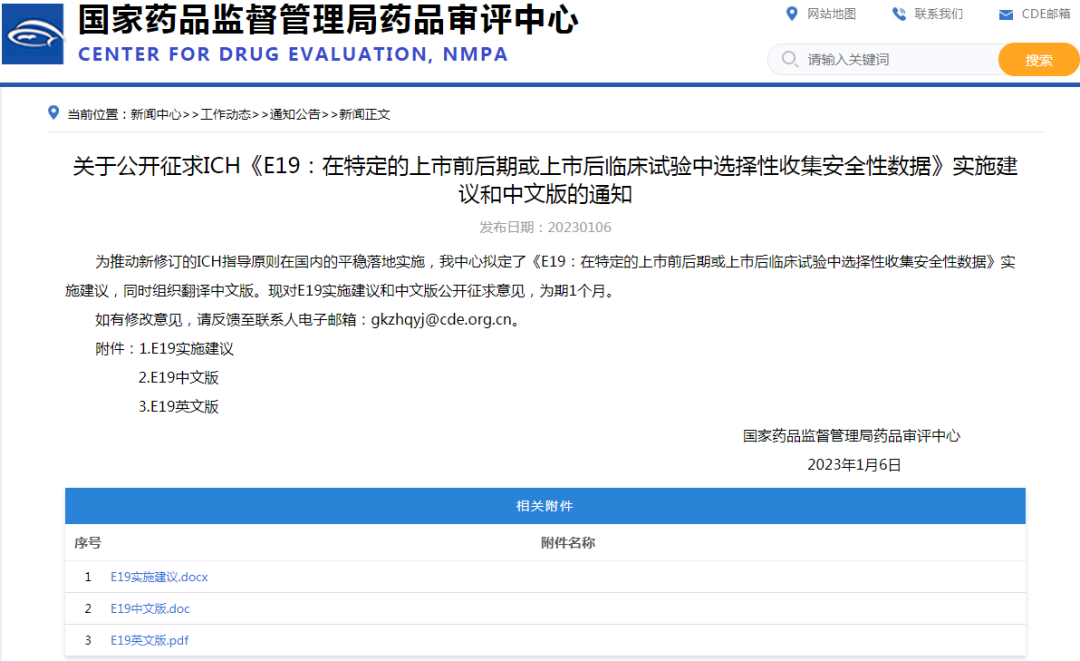
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/f141e2b5618619b89407ee49907c93cf

5、关于公开征求ICH《M11:临床电子结构化协调方案(CeSHarP)》指导原则草案意见的通知
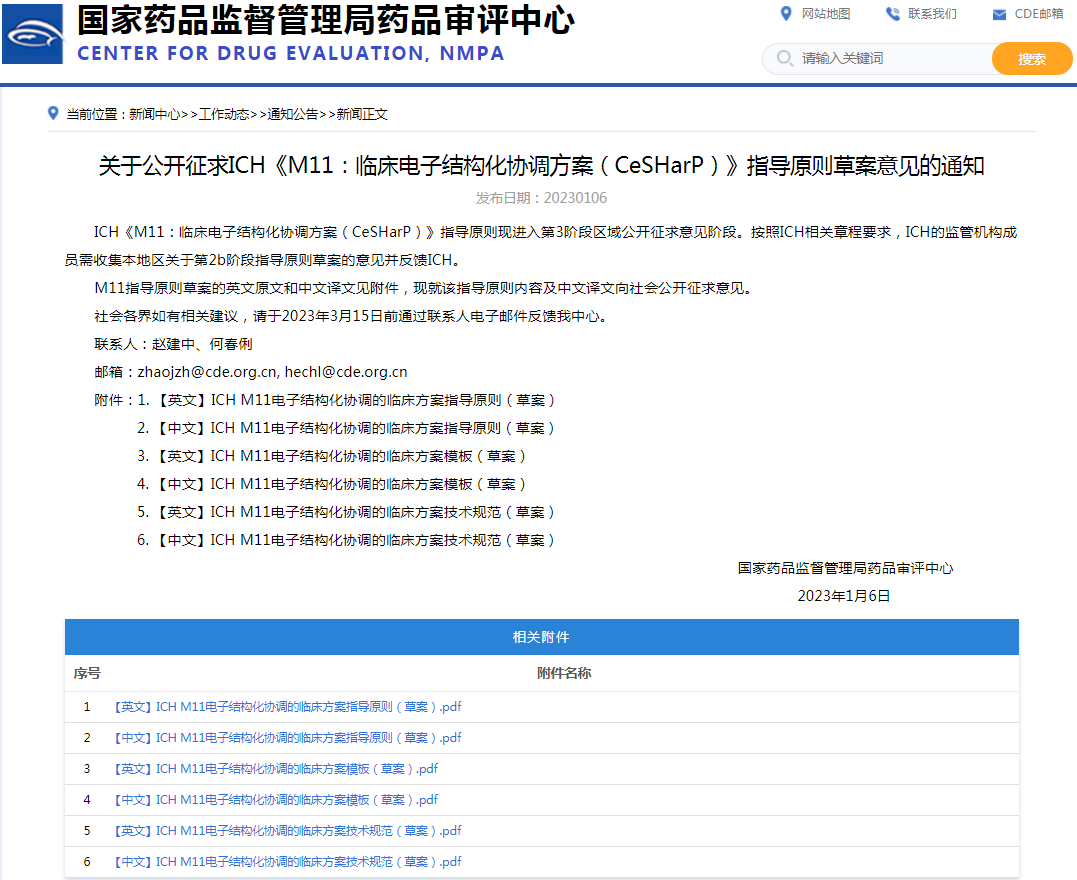
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/9557e3fa5cdeb3c752454a2e5c1d6dd8

6、关于公开征求《中药改良型新药研究技术指导原则(征求意见稿)》意见的通知
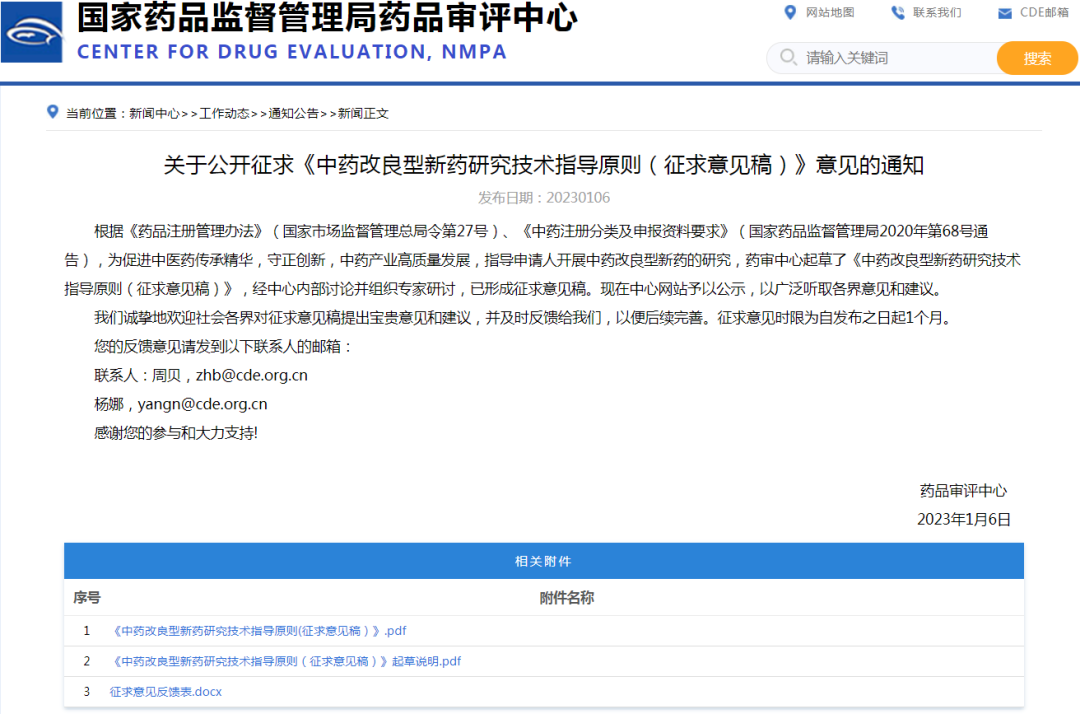
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/a4e163ea1eb3c92d100b8bcd397019bf

7、孔繁圃:多措并举提升药品审评效率和质量

四
CDE新承办信息公示类:
1、境内企业新药申报承办情况统计:
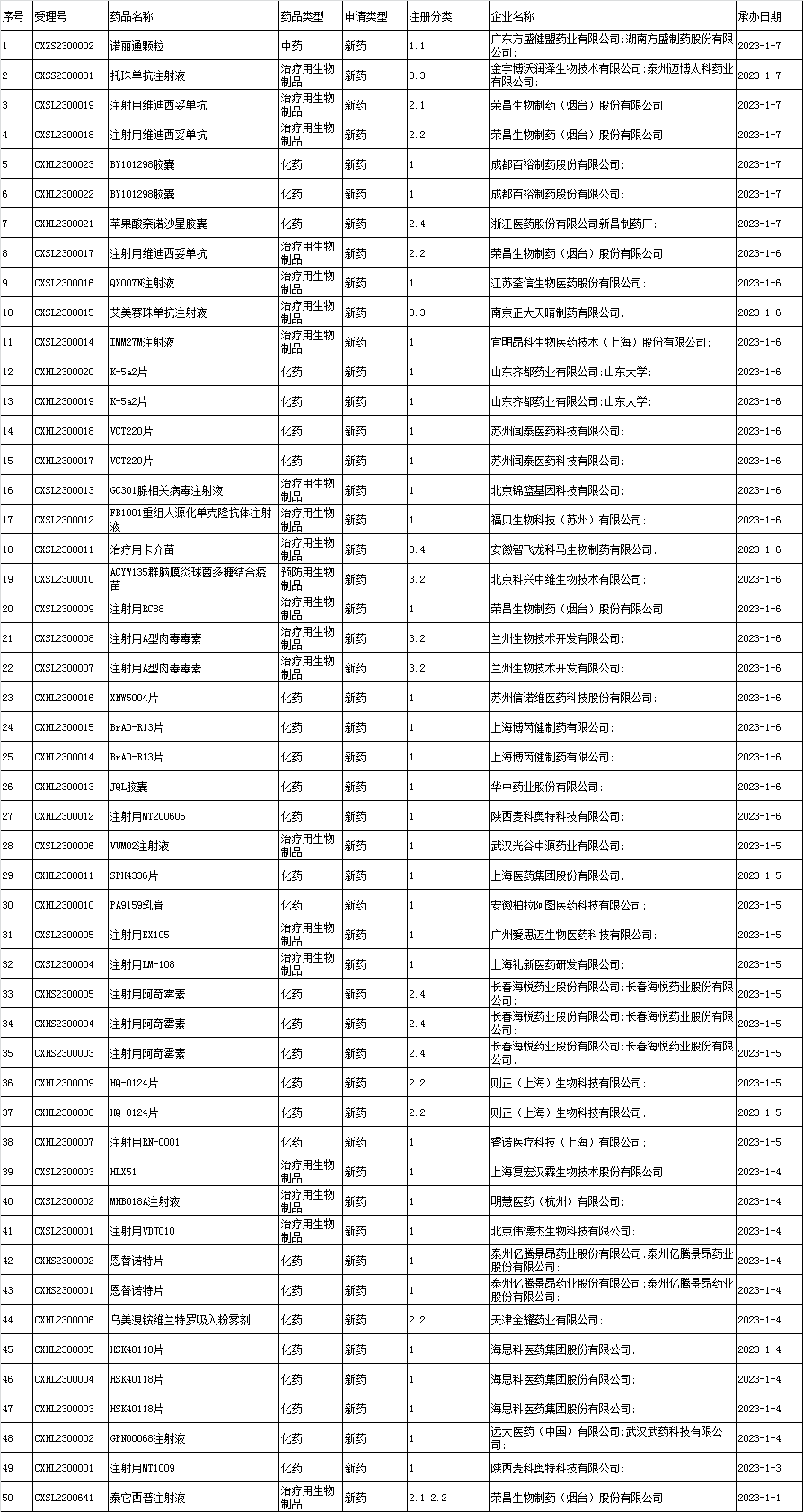
2、进口申报承办情况统计:
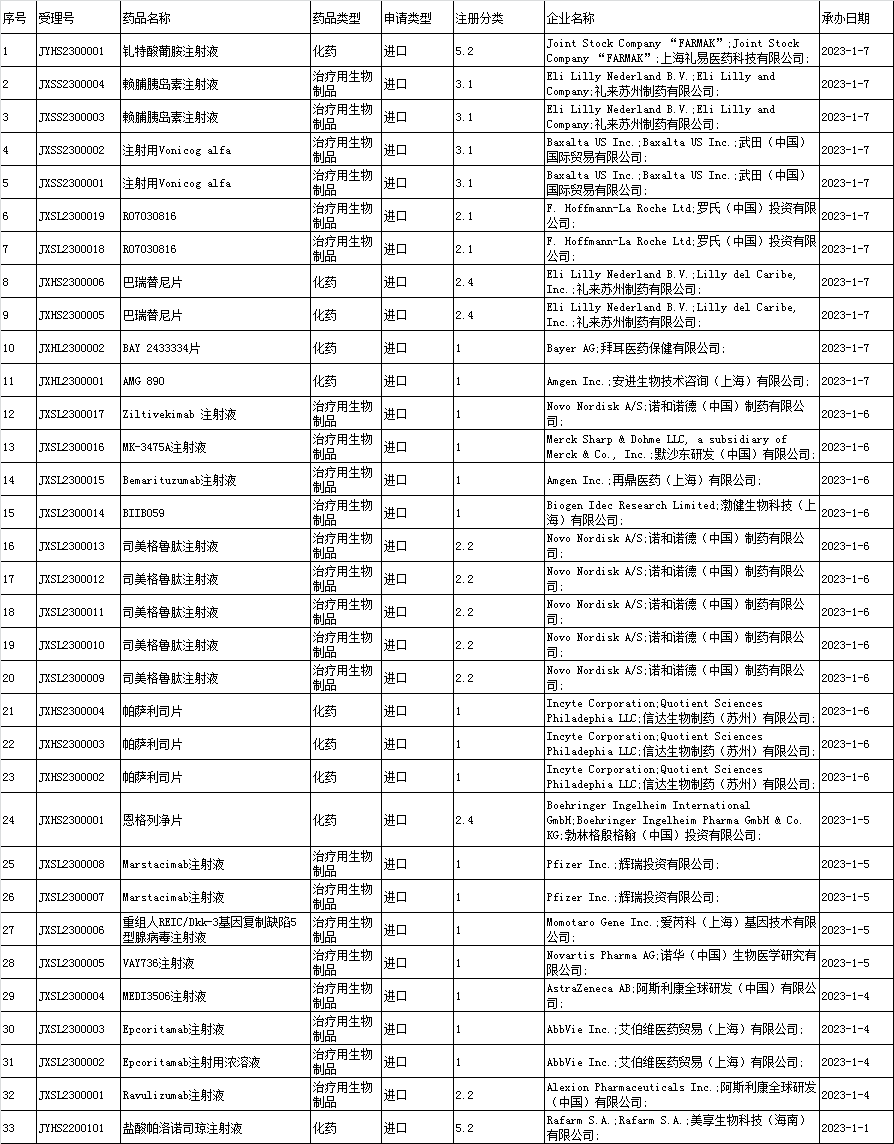
3、境内企业仿制药申报承办情况统计:
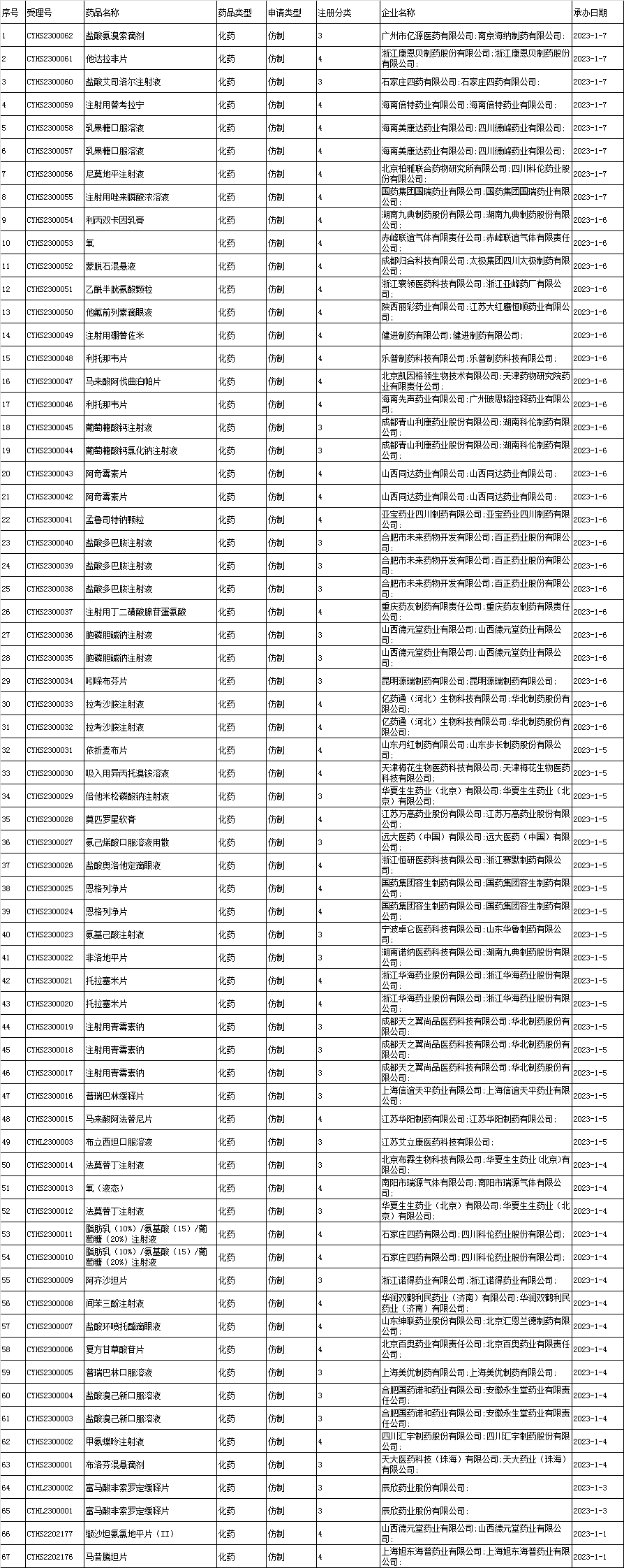
4、化药一致性评价申报承办情况统计:
(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:

(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
(3)国内改变处方工艺的一致性评价:
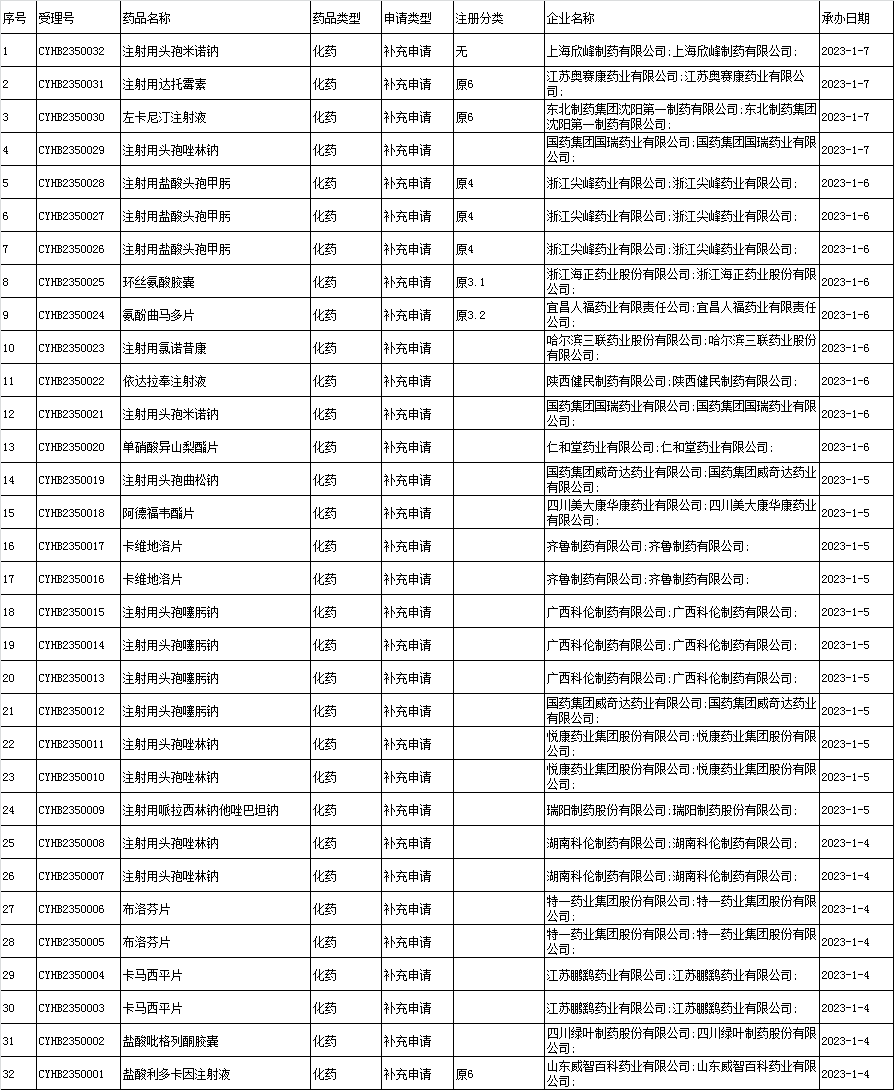
(4)进口改变处方工艺的一致性评价:本周无。
5、原料药登记信息公示:

6、药用辅料登记信息公示:
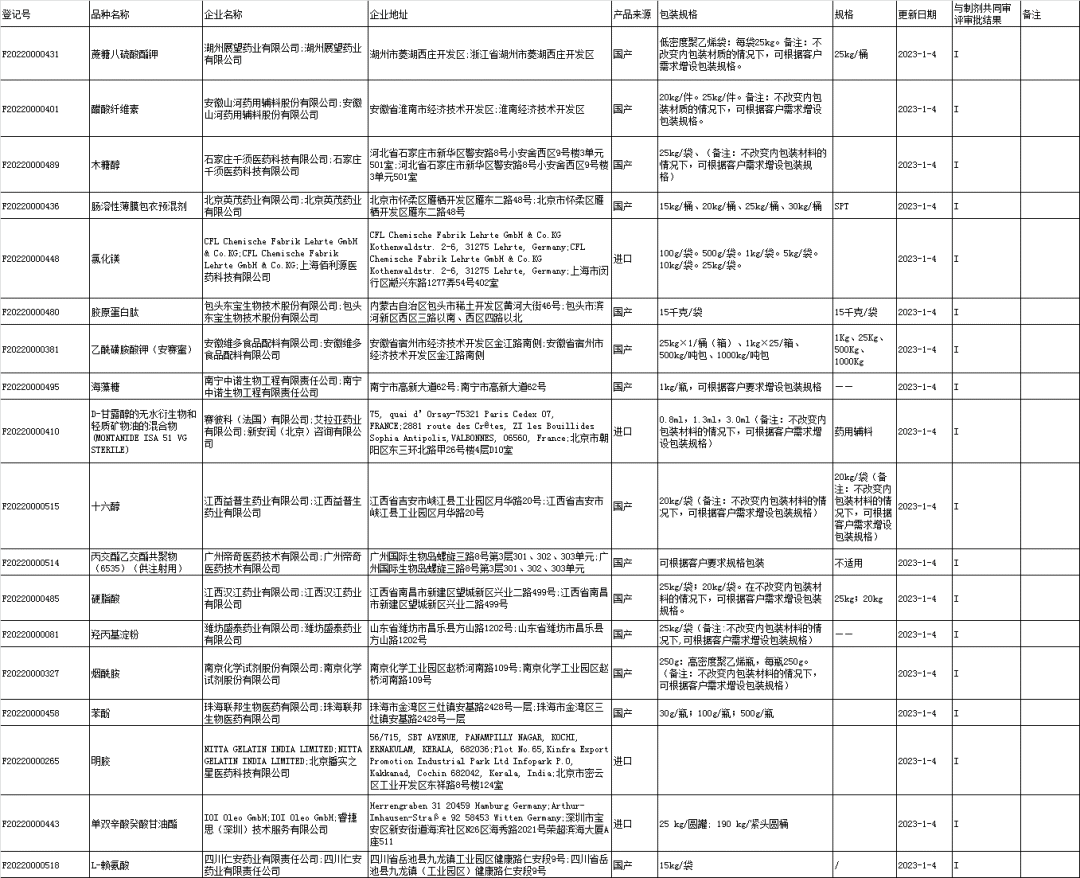
7、药包材登记信息公示:

五
CDE信息公示类:
1、临床试验默示许可:新增66条,共计9036条
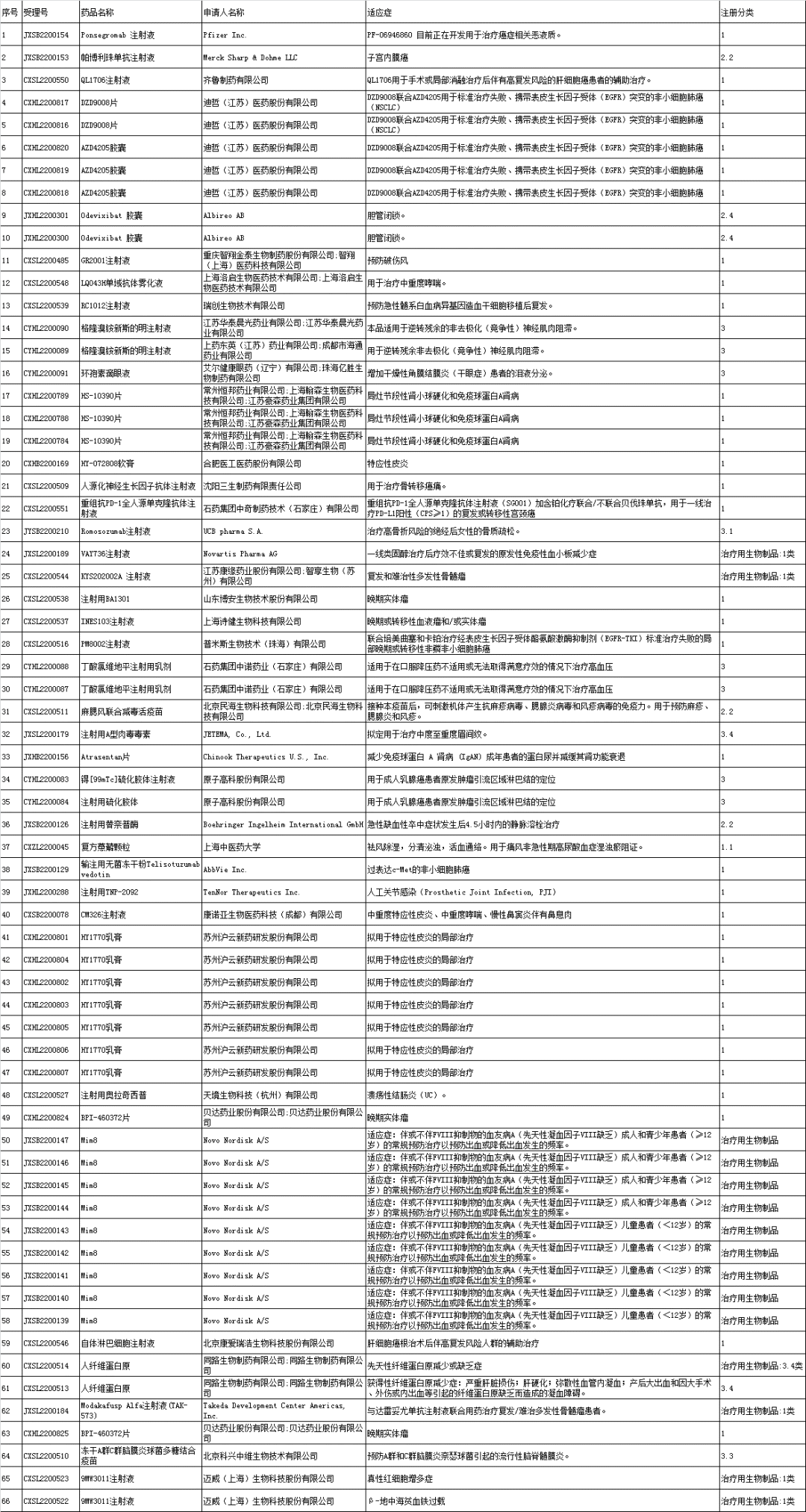
2、优先审评公示
(1)拟优先审评品种公示:Glofitamab (RO7082859)、舒沃替尼片


(2)纳入优先审评品种:本周无。
(3)异议论证结果查询:本周无。
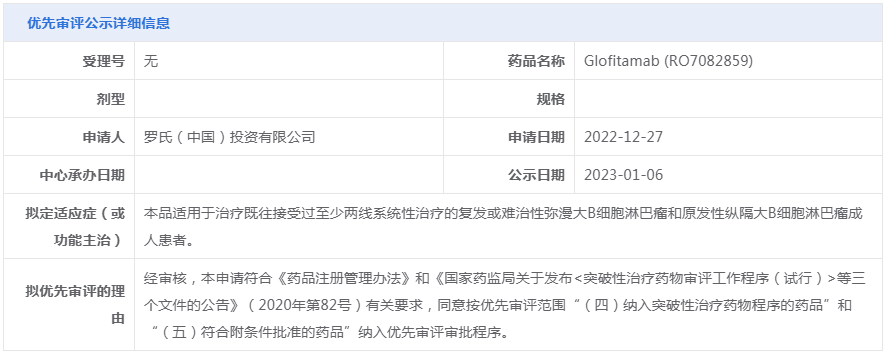
3、突破性治疗公示
(1)拟突破性治疗品种公示:本周无。
(2)纳入突破性治疗品种:GFH925片

(3)异议论证结果查询:本周无。
4、《化学仿制药参比制剂目录》的公示:本周无新增,第六十五批公示期限:2022年12月29日~2023年1月11日(10个工作日),公示共计六十五批
5、共性问题:
(1)受理共性问题:本周无新增,共计36条
(2)常见一般性技术问题:本周无新增,共计149条
6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
7、eCTD专栏 >> 常见问答:本周无新增,共计15条
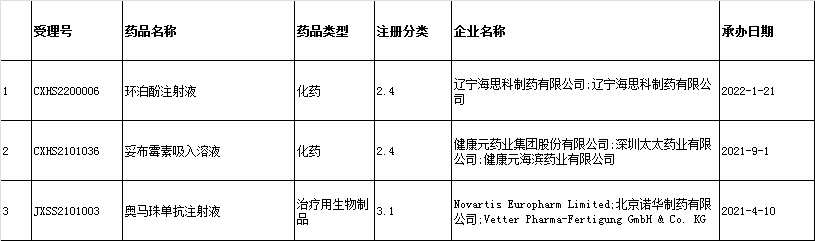
8、上市药品信息:新增3条,涉及3个品种为:环泊酚注射液、妥布霉素吸入溶液、奥马珠单抗注射液,信息公示共计1024条
(1) 2023年1月3日:新增3条,涉及3个品种为:环泊酚注射液、妥布霉素吸入溶液、奥马珠单抗注射液
六
CMDE发布公示信息:
1、创新医疗器械特别审查申请审查结果公示(2022年第9号)
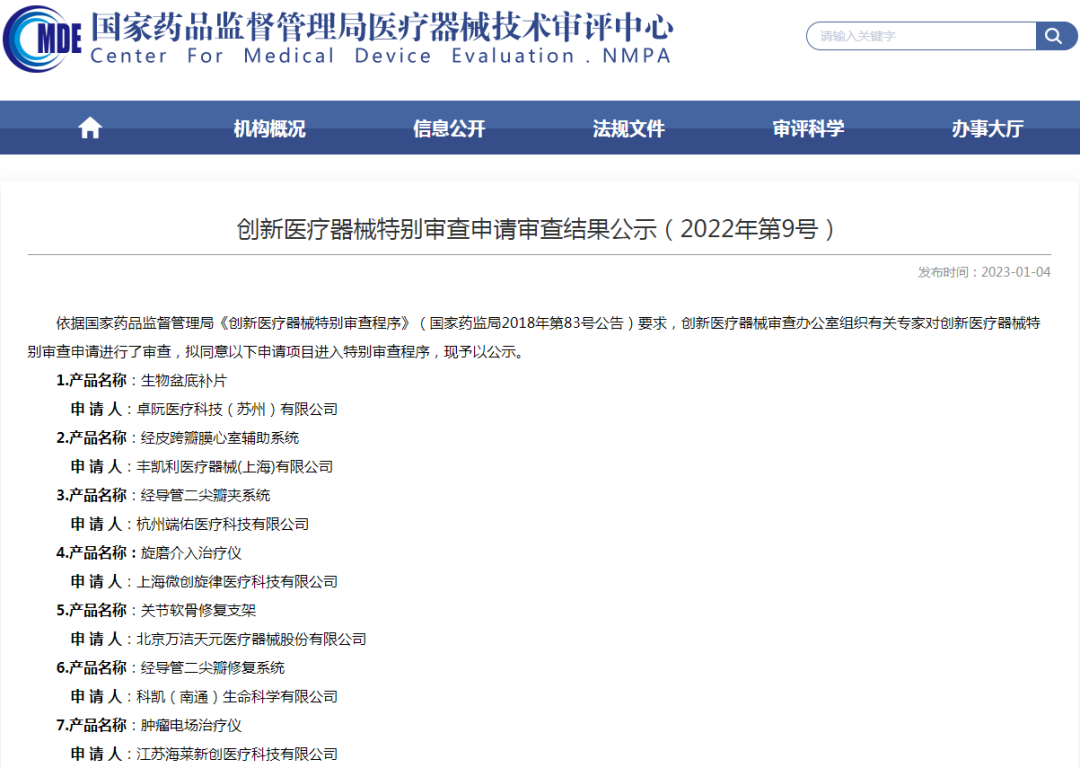

2、关于公开征求《重组胶原蛋白创面敷料注册审查指导原则(征求意见稿)》意见的通知
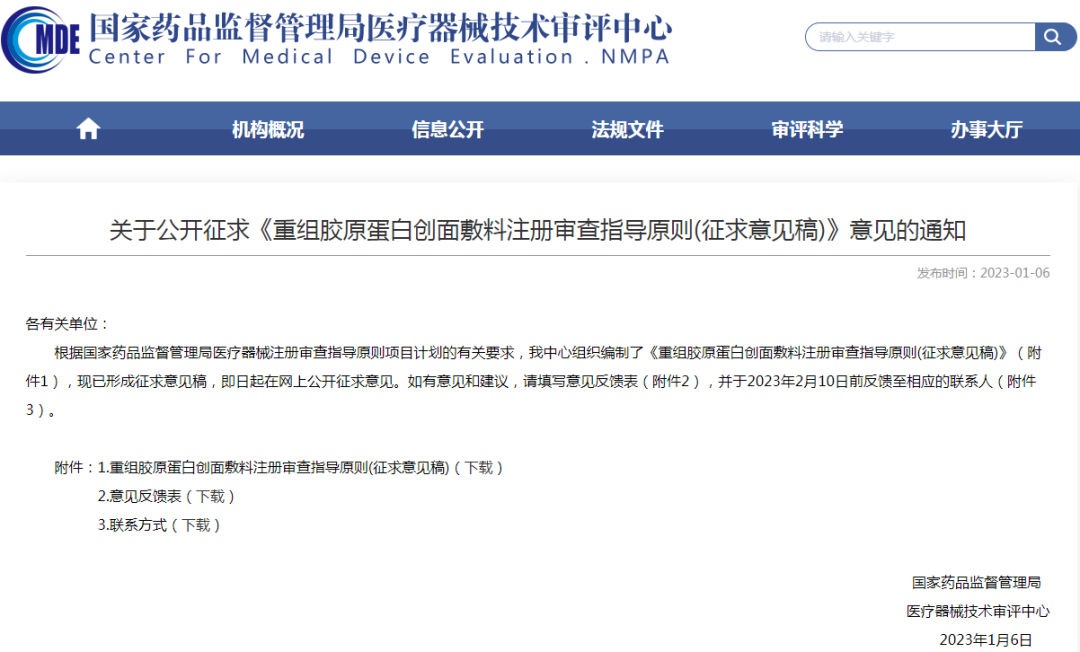
链接:
https://www.cmde.org.cn/xwdt/zxyw/20230106160827136.html

七
NMPAIC发布公示信息:
国家药监局发布《化妆品生产许可管理基本数据集》等5个化妆品信息化标准

八
CFDI发布公示信息:
本周无。
九
CHP发布公示信息:
1、国家药典委员会关于公开征求2023年度药品标准培训需求的通知

链接:
https://www.chp.org.cn/gjyjw/tz/17543.jhtml

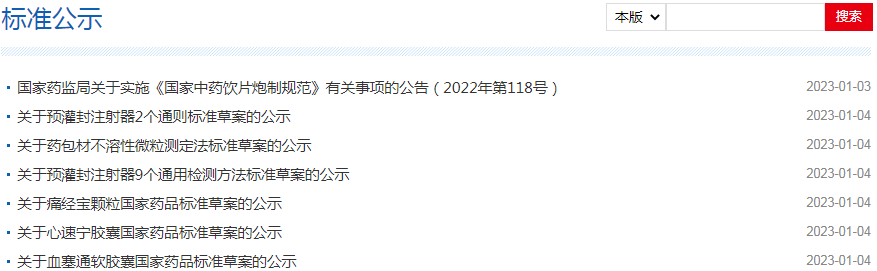
2、标准公示——预灌封注射器2个通则标准草案的公示、药包材不溶性微粒测定法标准草案的公示、预灌封注射器9个通用检测方法标准草案的公示、痛经宝颗粒国家药品标准草案的公示、心速宁胶囊国家药品标准草案的公示、血塞通软胶囊国家药品标准草案的公示
十
NIFDC发布公示信息:
本周无。
十一
CDR-ADR发布公示信息:
本周无。
十二
CFE-SAMR发布公示信息:
本周无。
十三
CNCSDR发布公示信息:
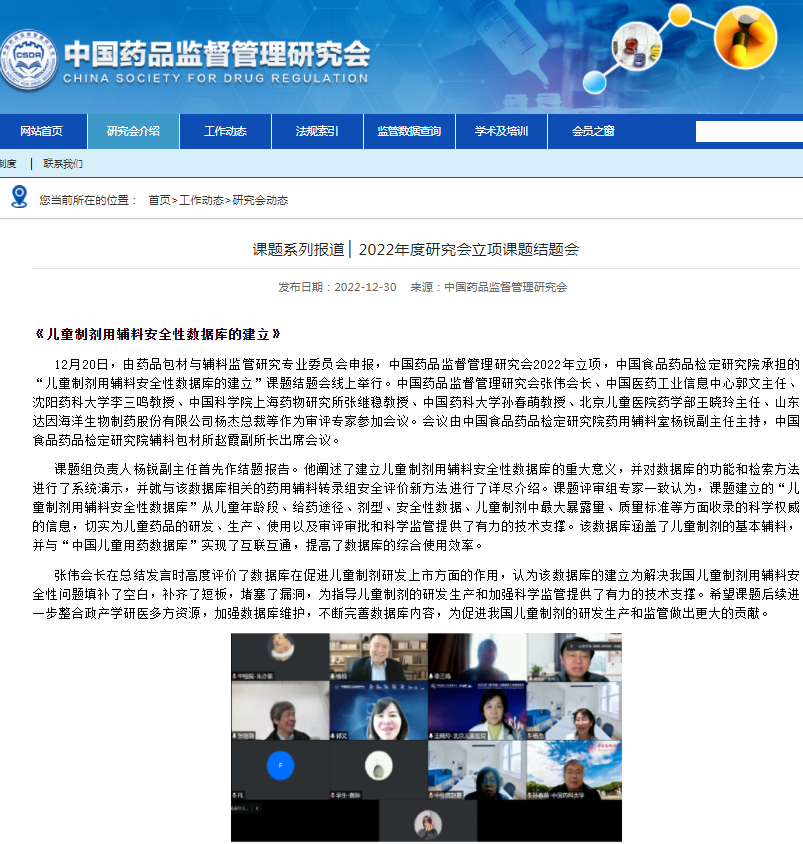
1、课题系列报道 ▏2022年度研究会立项课题结题会:《儿童制剂用辅料安全性数据库的建立》、《数据保护相关政策研究及展望》、《中国化妆品标准体系研究》、《化妆品注册备案中原料安全相关信息报送调查研究》、《人工智能医疗器械全生命周期动态管理体系研究》、《医疗器械安全公众满意度方法构建与实践研究》、《临床试验安全性评价与风险预警的智能化药物警戒体系研究》、《基于风险管理的医疗器械科学监管体系模型》、《社会组织在化妆品安全治理中的作用研究》



2、国家药监局委托课题系列报道 ▏2022年度研究会立项课题结题会:新《药品管理法》背景下药品标准形成机制研究





