国家药监局及直属单位药品相关数据信息一周集锦(2022-07-04至2022-07-09)


目录
☆一、NMPA政策文件发布征求类:
★1、关于发布YY /T 1833.1-2022《人工智能医疗器械 质量要求和评价 第1部分:术语》等18项医疗器械行业标准的公告(2022年第52号)
★2、关于发布《疫苗生产流通管理规定》的公告(2022年 第55号)
★3、国家药监局综合司公开征求《中药饮片包装标签管理规定(征求意见稿)》及配套技术文件意见
☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布54批。
▲3、说明书修订信息:本周无。
▲4、药品批准证明文件待领取信息发布:
△2022年7月4日
△2022年7月6日
△2022年7月7日
△2022年7月8日
▲5、药品通知件待领取信息发布:
△2022年7月4日
△2022年7月5日
△2022年7月7日
△2022年7月8日
▲6、药品批准证明文件(纠错)待领取信息:
△2022年7月4日
△2022年7月5日
▲7、中药品种保护信息公示:复方芩兰口服液(续保)、十味益脾颗粒(初保)。
▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、关于开展模型引导的药物研发(MIDD)在新药研发企业的实践情况调研的通知
◆2、关于公开征求《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》意见的通知
◆3、关于公开征求《抗体偶联药物非临床研究技术指导原则(征求意见稿)》意见的通知
◆4、关于公开征求《药品审评过程中有因检查启动工作程序(征求意见稿)》意见的通知
◆5、关于公开征求《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则(征求意见稿)》意见的通知
◆6、关于《药物真实世界研究设计与方案框架指导原则(征求意见稿)》公开征求意见的通知
◆7、关于公开征求《注射用两性霉素B脂质体生物等效性研究技术指导原则(征求意见稿)》意见的通知
☆四、CDE新承办信息公示类
■1、境内企业新药申报承办情况统计
■2、进口申报承办情况统计:
■3、境内企业仿制药申报承办情况统计:
■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:
□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
□(4)进口改变处方工艺的一致性评价:本周无。
■5、原料药登记信息公示:
■6、药用辅料登记信息公示:
■7、药包材登记信息公示:
☆五、CDE信息公示类
●1、临床试验默示许可:新增42条,共计7574条
●2、优先审评公示
○(1)拟优先审评品种公示:纳乐舒单抗注射液、安纳白介素注射液(预充式)
○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
○(1)拟突破性治疗品种公示:NR082眼用注射液、抗人BCMA T细胞注射液、OAV101注射液
○(2)纳入突破性治疗品种:注射用SKB264
○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周新增第六十批,公示期限:2022年7月5日~2022年7月18日(10个工作日),公示共计六十批
○(1)化学仿制药尚未发布参比制剂目录(第六十批)(征求意见稿)
○(2)已发布化学仿制药参比制剂增补目录(征求意见稿)
○(3)未通过审议品种目录
○(4)再议品种目录
●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
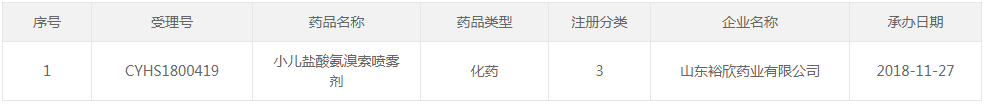
●8、上市药品信息:新增15条,涉及8个品种为:盐酸安罗替尼胶囊、注射用重组人凝血因子IX -Fc融合蛋白、注射用头孢哌酮钠他唑巴坦钠(6:1)、盐酸恩沙替尼胶囊、阿替利珠单抗注射液、甲磺酸阿美替尼片、替雷利珠单抗注射液、小儿盐酸氨溴索喷雾剂,信息公示共计911条
○(1)2022年7月4日:新增7条,涉及2个品种为:盐酸安罗替尼胶囊、注射用重组人凝血因子IX -Fc融合蛋白
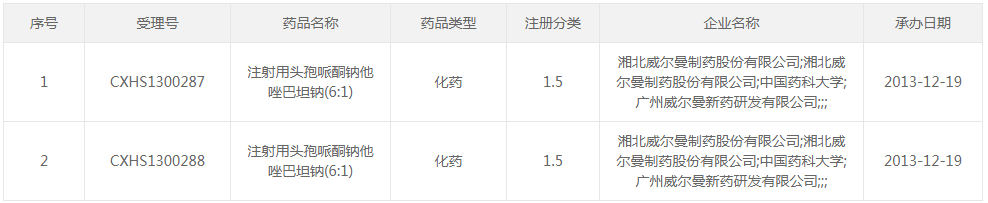
○(2)2022年7月5日:新增2条,涉及1个品种为:注射用头孢哌酮钠他唑巴坦钠(6:1)
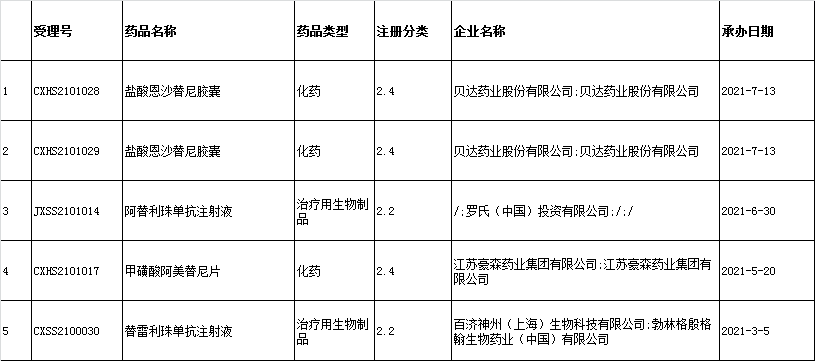
○(3)2022年7月6日:新增5条,涉及4个品种为:盐酸恩沙替尼胶囊、阿替利珠单抗注射液、甲磺酸阿美替尼片、替雷利珠单抗注射液
○(4)2022年7月7日:新增1条,涉及1个品种为:小儿盐酸氨溴索喷雾剂
☆六、CMDE发布公示信息:
⊙关于公开征求免于进行临床评价医疗器械目录和免于临床试验体外诊断试剂目录意见的通知
☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:本周无。
☆九、CHP发布公示信息:
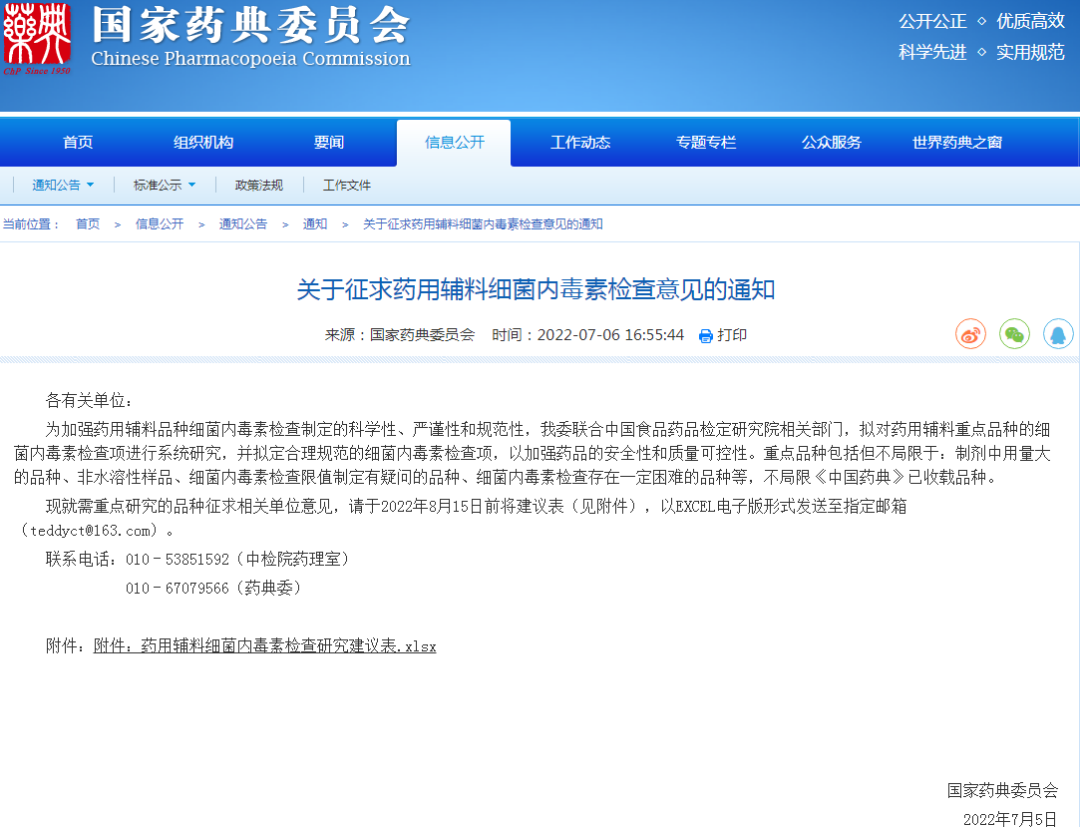
◎关于征求药用辅料细菌内毒素检查意见的通知
◎标准公示——炒槐花(槐花)配方颗粒国家药品标准的公示(第二次)、氮药用辅料标准草案、氮药用辅料标准草案、克林霉素磷酸酯注射液国家药品标准草案、盐酸林可霉素注射液国家药品标准草案
☆十、NIFDC发布公示信息:本周无。
☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:本周无。
☆十三、CNCSDR发布公示信息:
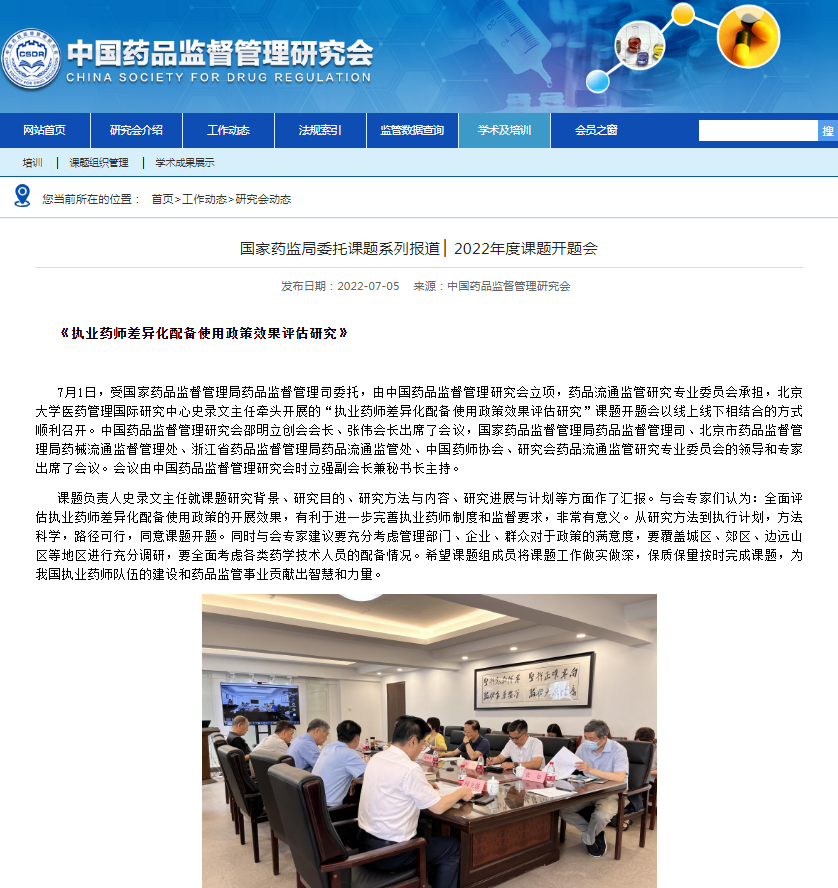
£国家药监局委托课题系列报道 ▏2022年度课题开题会

☆一、NMPA政策文件发布征求类:
★1、关于发布YY /T 1833.1-2022《人工智能医疗器械 质量要求和评价 第1部分:术语》等18项医疗器械行业标准的公告(2022年第52号)

链接:
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220706104425173.html

★2、关于发布《疫苗生产流通管理规定》的公告(2022年 第55号)

链接:
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20220708185734126.html

★3、国家药监局综合司公开征求《中药饮片包装标签管理规定(征求意见稿)》及配套技术文件意见

链接:
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220708162721154.html

☆二、NMPA信息公示类
▲1、上市批准信息公示:
△新药上市批准信息公示:本周无。
△其他上市信息公示:本周无。
▲2、仿制药参比制剂目录发布信息:本周无新增,共计发布54批。
▲3、说明书修订信息:本周无。
▲4、药品批准证明文件待领取信息发布:
△2022年7月4日

△2022年7月6日

△2022年7月7日

△2022年7月8日

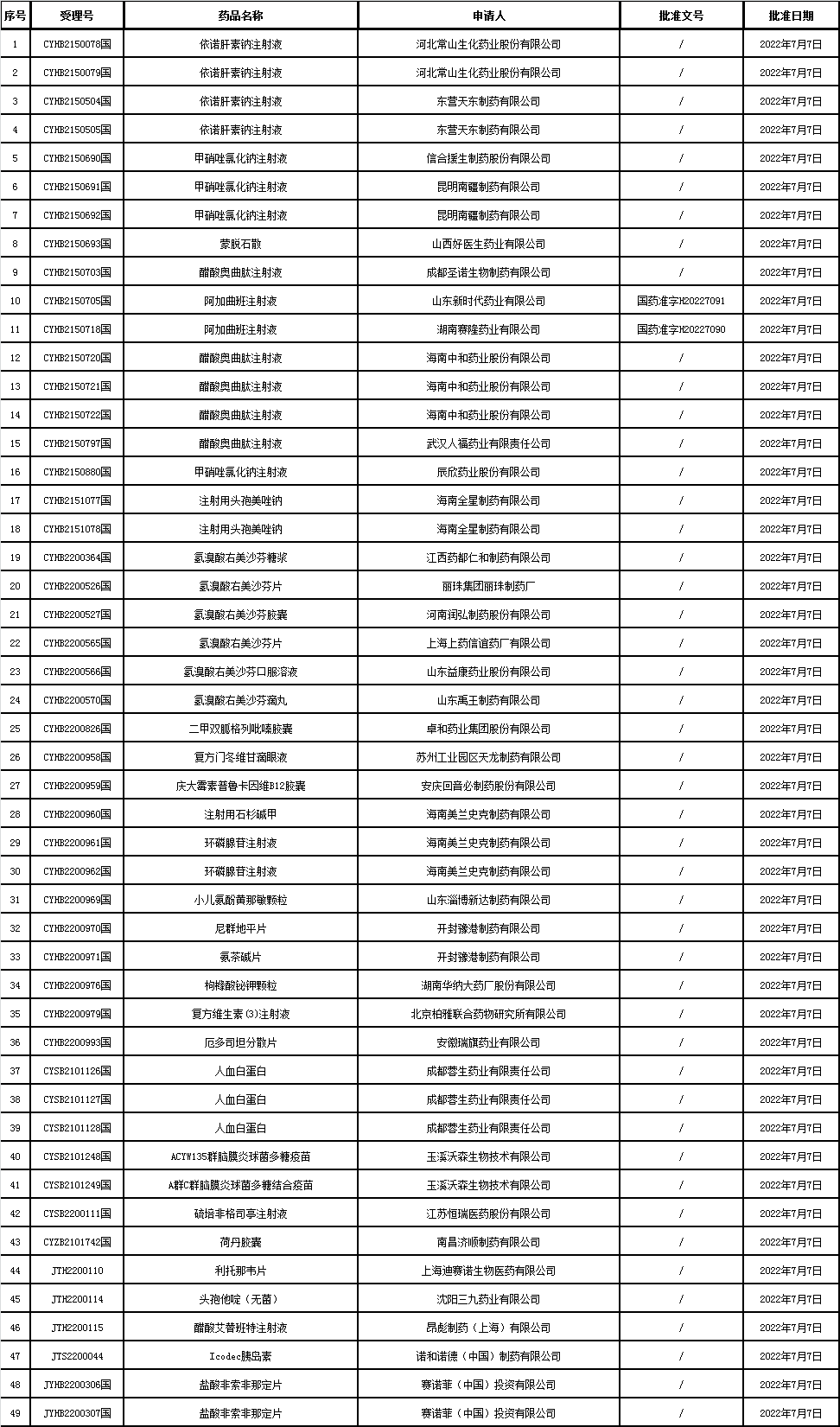
▲5、药品通知件待领取信息发布:
△2022年7月4日

△2022年7月5日

△2022年7月7日
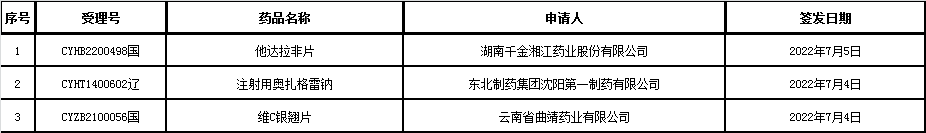
△2022年7月8日

▲6、药品批准证明文件(纠错)待领取信息:
△2022年7月4日

△2022年7月5日

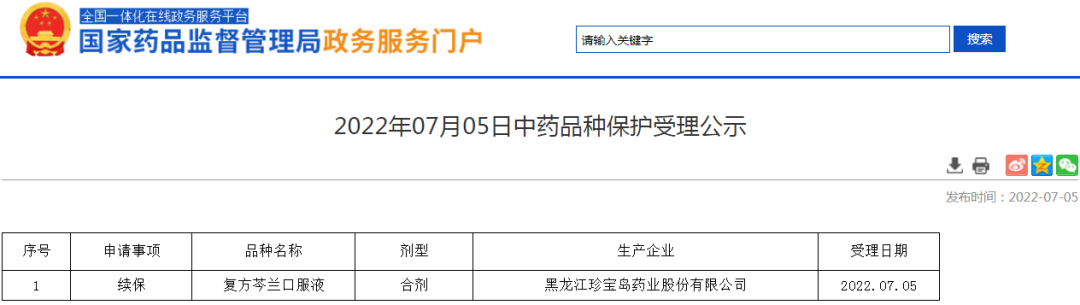
▲7、中药品种保护信息公示:复方芩兰口服液(续保)、十味益脾颗粒(初保)。

▲8、药品注册证书注销、暂停进口信息:本周无。
▲9、补充检验方法信息:本周无。
☆三、CDE药品技术指导原则、指南发布类征求类:
◆1、关于开展模型引导的药物研发(MIDD)在新药研发企业的实践情况调研的通知
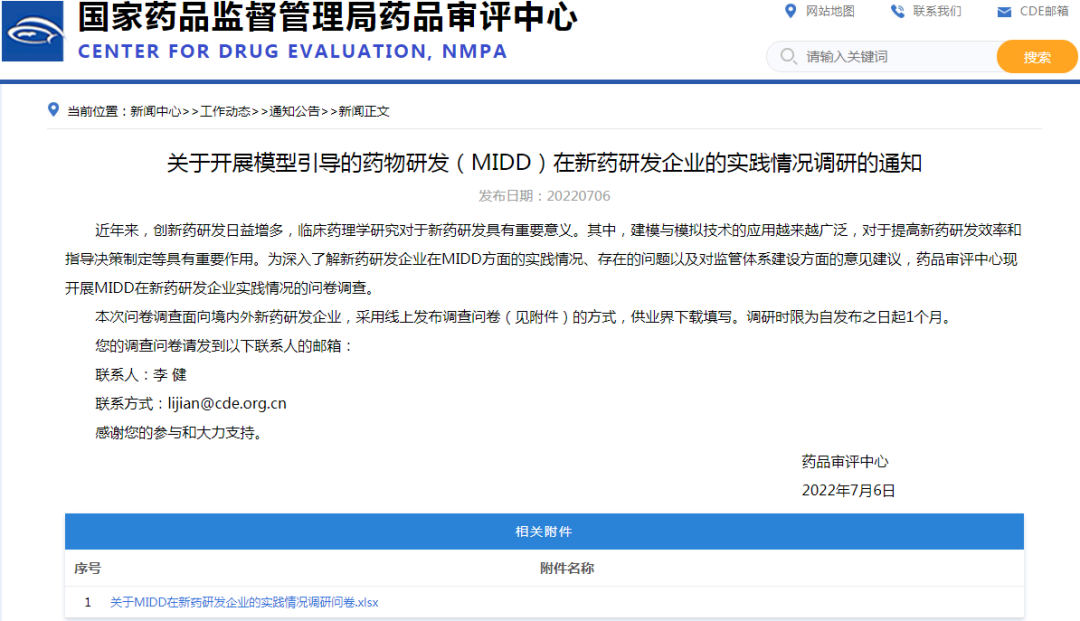
链接:
https://www.cde.org.cn/main/news/viewInfoCommon/b8997214e6db4c668343a93456aafec9

◆2、关于公开征求《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/2981a587ba89aa3368130ac1565fb04f

◆3、关于公开征求《抗体偶联药物非临床研究技术指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/5f12f0ff6dcf78f59186db18fe517fa8

◆4、关于公开征求《药品审评过程中有因检查启动工作程序(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/7923d1b846841360c4448bddda45db1a

◆5、关于公开征求《化学仿制药口服调释制剂乙醇剂量倾泻试验药学研究技术指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/9dc69d67b2029d2671fb6e107ce7b16c

◆6、关于《药物真实世界研究设计与方案框架指导原则(征求意见稿)》公开征求意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/ea778658adc3d1ae3ffe3f1cc0522e5e

◆7、关于公开征求《注射用两性霉素B脂质体生物等效性研究技术指导原则(征求意见稿)》意见的通知

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/267dfbc1e7f8af6456ac1ea4f9ba0981

☆四、CDE新承办信息公示类
■1、境内企业新药申报承办情况统计
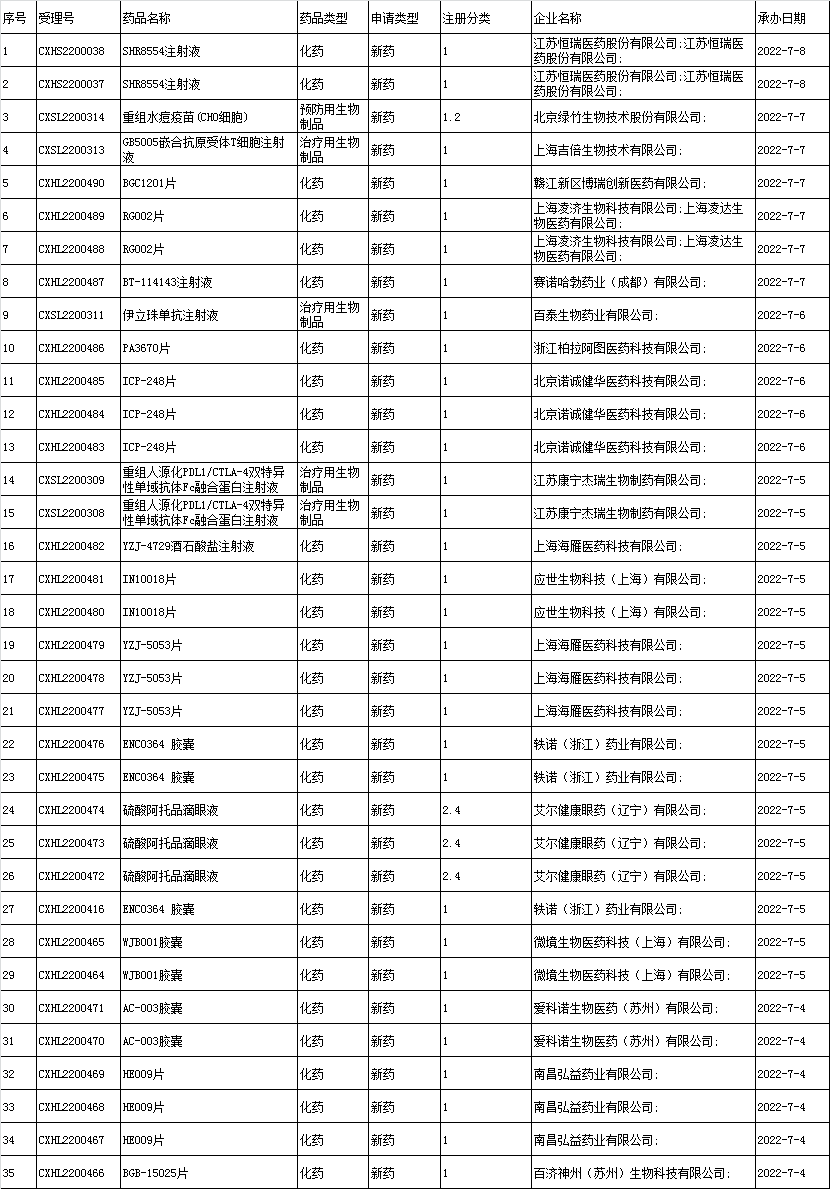
■2、进口申报承办情况统计:
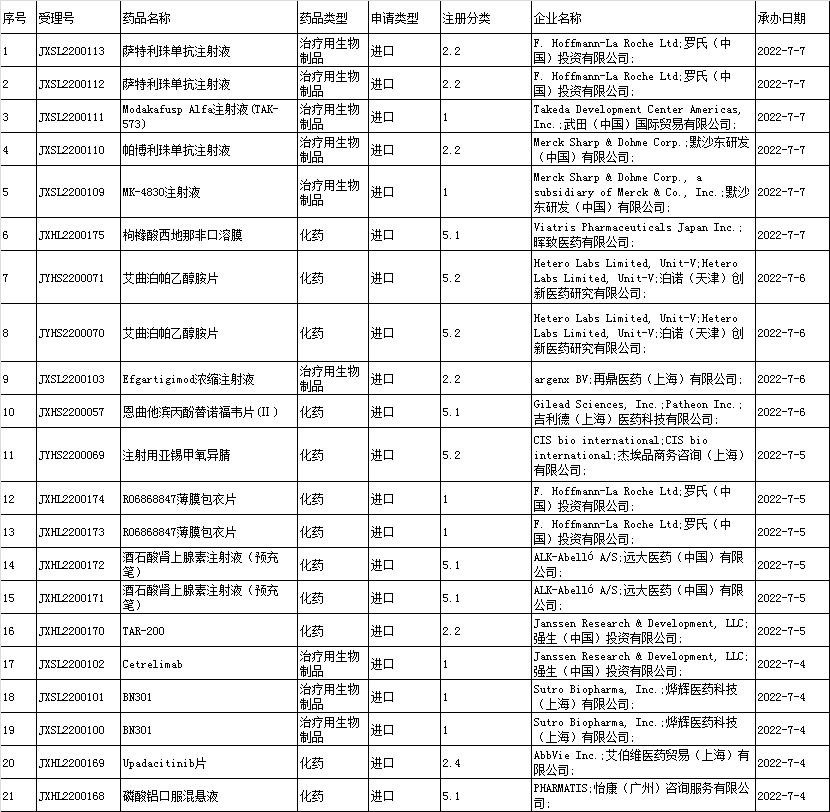
■3、境内企业仿制药申报承办情况统计:

■4、化药一致性评价申报承办情况统计:
□(1)国内未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:

□(2)进口未改变处方工艺的一致性评价申请或提出免于参加一致性评价的申请:本周无。
□(3)国内改变处方工艺的一致性评价:
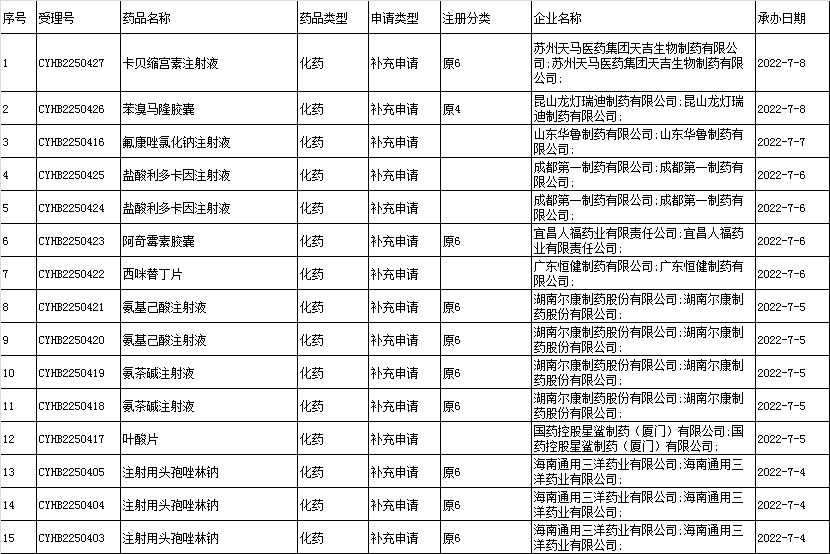
□(4)进口改变处方工艺的一致性评价:本周无。
■5、原料药登记信息公示:
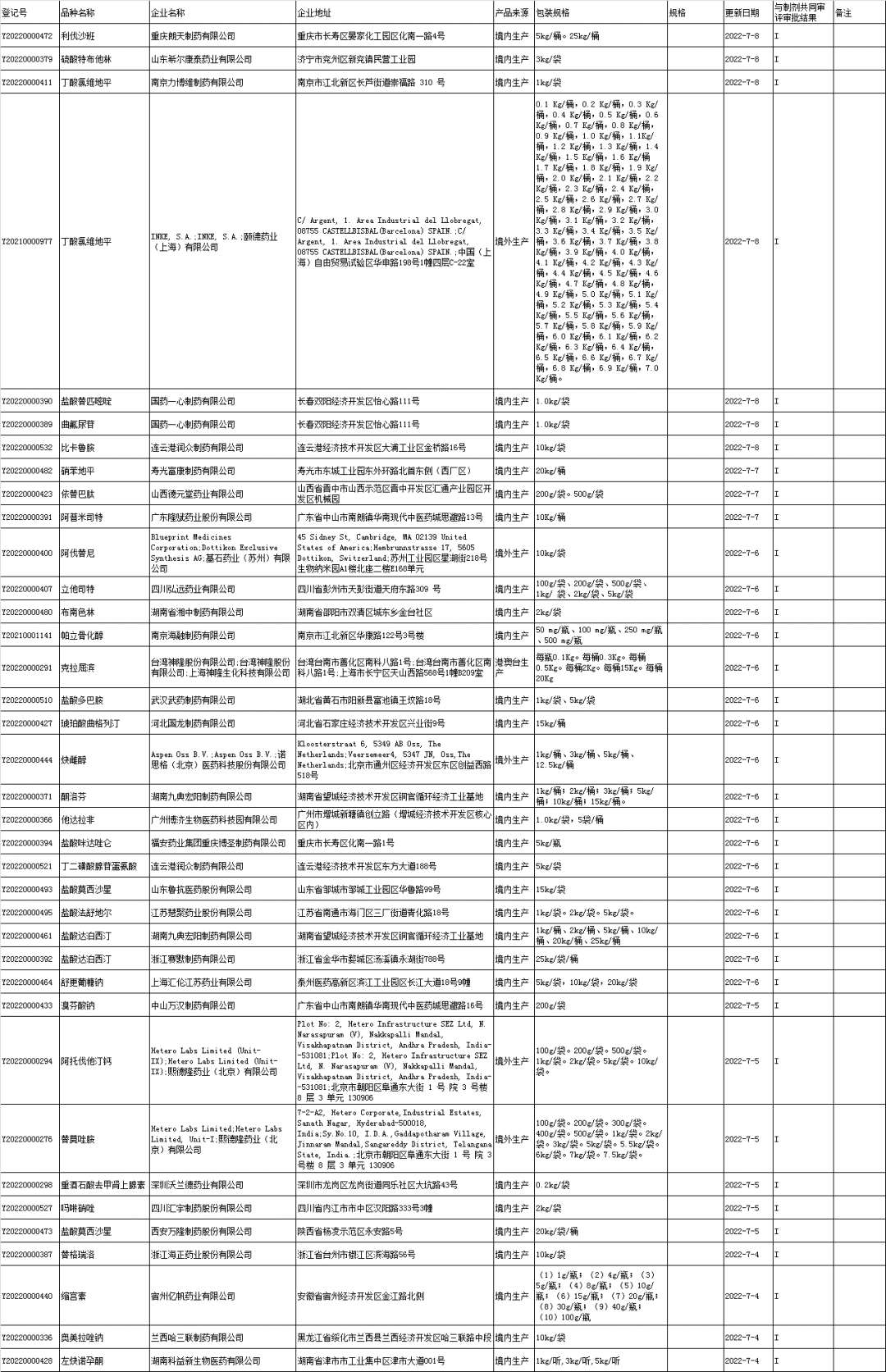
■6、药用辅料登记信息公示:

■7、药包材登记信息公示:

☆五、CDE信息公示类
●1、临床试验默示许可:新增42条,共计7574条

●2、优先审评公示
○(1)拟优先审评品种公示:纳乐舒单抗注射液、安纳白介素注射液(预充式)



○(2)纳入优先审评品种:本周无。
○(3)异议论证结果查询:本周无。
●3、突破性治疗公示
○(1)拟突破性治疗品种公示:NR082眼用注射液、抗人BCMA T细胞注射液、OAV101注射液


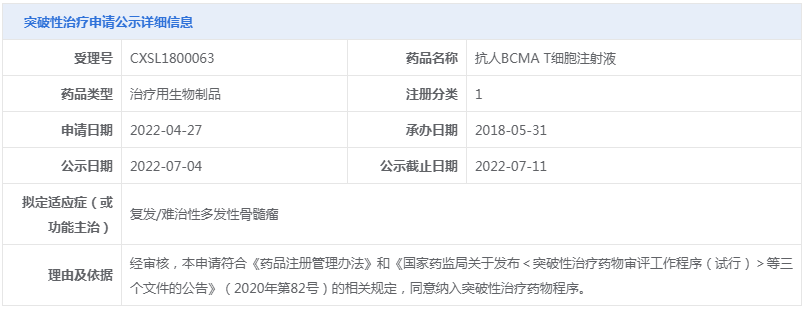

○(2)纳入突破性治疗品种:注射用SKB264


○(3)异议论证结果查询:本周无。
●4、《化学仿制药参比制剂目录》的公示:本周新增第六十批,公示期限:2022年7月5日~2022年7月18日(10个工作日),公示共计六十批

链接:
https://www.cde.org.cn/main/news/viewInfoCommon/ee7c627ae8ef649e63aeae0c085043ed

○(1)化学仿制药尚未发布参比制剂目录(第六十批)(征求意见稿)


○(2)已发布化学仿制药参比制剂增补目录(征求意见稿)
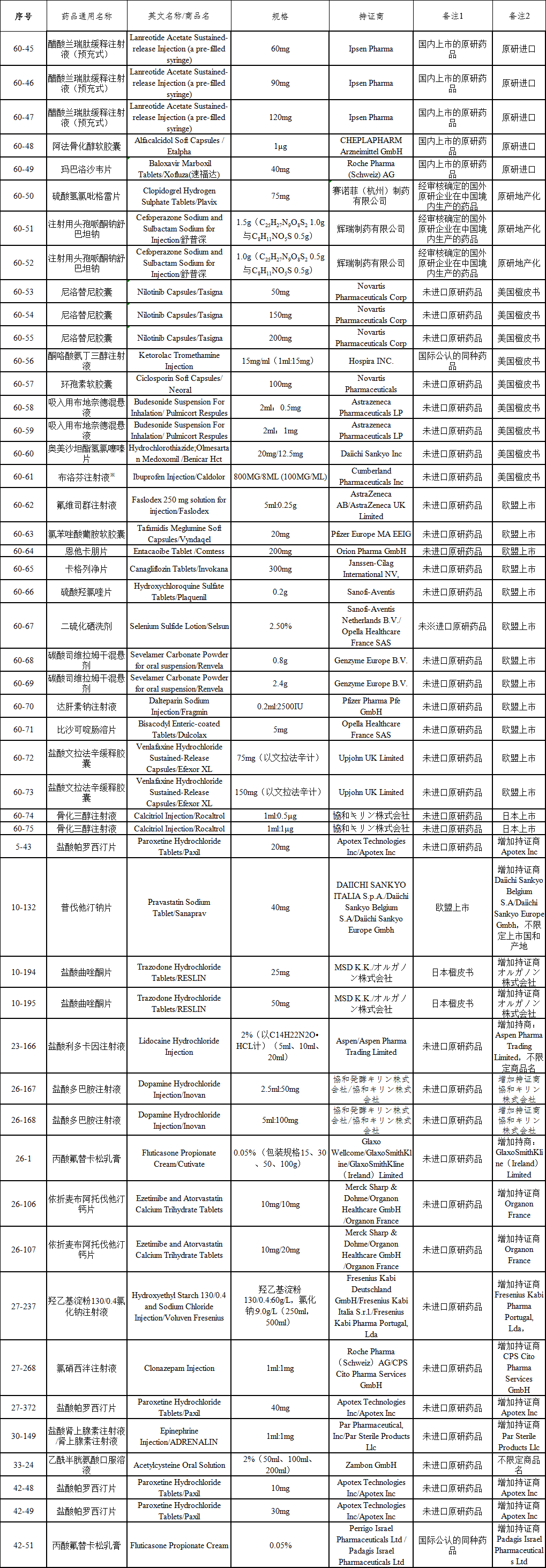

○(3)未通过审议品种目录

○(4)再议品种目录

●5、共性问题:
○(1)受理共性问题:本周无新增,共计36条
○(2)常见一般性技术问题:本周无新增,共计144条
●6、仿制药质量和疗效一致性评价百问百答:本周无新增,共计3期41个问答
●7、eCTD专栏 >> 常见问答:本周无新增,共计10条
●8、上市药品信息:新增15条,涉及8个品种为:盐酸安罗替尼胶囊、注射用重组人凝血因子IX -Fc融合蛋白、注射用头孢哌酮钠他唑巴坦钠(6:1)、盐酸恩沙替尼胶囊、阿替利珠单抗注射液、甲磺酸阿美替尼片、替雷利珠单抗注射液、小儿盐酸氨溴索喷雾剂,信息公示共计911条
○(1)2022年7月4日:新增7条,涉及2个品种为:盐酸安罗替尼胶囊、注射用重组人凝血因子IX -Fc融合蛋白

○(2)2022年7月5日:新增2条,涉及1个品种为:注射用头孢哌酮钠他唑巴坦钠(6:1)
○(3)2022年7月6日:新增5条,涉及4个品种为:盐酸恩沙替尼胶囊、阿替利珠单抗注射液、甲磺酸阿美替尼片、替雷利珠单抗注射液
○(4)2022年7月7日:新增1条,涉及1个品种为:小儿盐酸氨溴索喷雾剂
☆六、CMDE发布公示信息:
⊙关于公开征求免于进行临床评价医疗器械目录和免于临床试验体外诊断试剂目录意见的通知

链接:
https://www.cmde.org.cn/xwdt/zxyw/20220705144811103.html

☆七、NMPAIC发布公示信息:本周无。
☆八、CFDI发布公示信息:本周无。
☆九、CHP发布公示信息:
◎关于征求药用辅料细菌内毒素检查意见的通知
链接:
https://www.chp.org.cn/gjyjw/tz/17099.jhtml

◎标准公示——炒槐花(槐花)配方颗粒国家药品标准的公示(第二次)、氮药用辅料标准草案、氮药用辅料标准草案、克林霉素磷酸酯注射液国家药品标准草案、盐酸林可霉素注射液国家药品标准草案

☆十、NIFDC发布公示信息:本周无。
☆十一、CDR-ADR发布公示信息:本周无。
☆十二、CFE-SAMR发布公示信息:本周无。
☆十三、CNCSDR发布公示信息:
£国家药监局委托课题系列报道 ▏2022年度课题开题会

精彩专题
“凝聚红色力量,践行初心使命”阳光诺庆祝建党101华诞主题活动
《药视情报站》05期-对抗“儿童杀手—ALL“,微片技术显神功





